题目内容
13.如图1所示,在甲、乙两容器中分别充入等物质的量的CH4和H2O(g),进行反应:CH4(g)+H2O(g)?CO(g)+3H2(g),使甲、乙两容器初始容积相等,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CH4的转化率随时间变化的图象.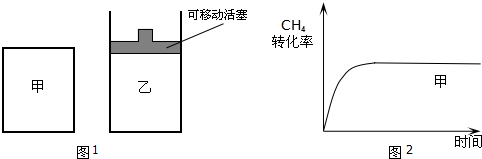
分析 甲为恒容密闭容器,乙为恒压密闭容器,随着反应进行,气体总物质的量增加,所以甲中压强逐渐增大,乙为恒压,比甲压强小,所以乙中反应速率小于甲,达到平衡状态时乙中甲烷转化率大于甲,且反应达到平衡的时间比甲长.
解答 解:甲为恒容密闭容器,乙为恒压密闭容器,随着反应进行,气体总物质的量增加,所以甲中压强逐渐增大,乙为恒压,比甲压强小,所以乙中反应速率小于甲,达到平衡状态时乙中甲烷转化率大于甲,且反应达到平衡的时间比甲长,所以乙的图象为 ,故答案为:
,故答案为: .
.
点评 本题考查化学平衡影响因素,为高频考点,侧重考查学生分析判断及计算能力,题目难度中等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
5.现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
18. 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
(1)一定温度下,反应2NO2(g)?N2O4 (g)△S<0,该反应能自发进行的原因是△H<0(选填“=”、“>”、“<”)
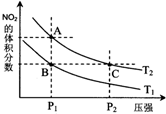
(2)对反应2NO2(g)?N2O4(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.0025mol•(L•s)-1.
②2NO2(g)?N2O4(g)该反应的平衡常数K的值为2.8;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正>v逆(填“>”、“<”或“=”),升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.(1)一定温度下,反应2NO2(g)?N2O4 (g)△S<0,该反应能自发进行的原因是△H<0(选填“=”、“>”、“<”)
(2)对反应2NO2(g)?N2O4(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②2NO2(g)?N2O4(g)该反应的平衡常数K的值为2.8;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正>v逆(填“>”、“<”或“=”),升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
5.高炉炼铁过程中发生的主要反应为$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
2.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0,达到化学平衡.下列有关叙述正确的是( )
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
3.等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液完全反应后,溶液中有关离子浓度之间不存在的关系是( )
| A. | c(H+)•c(OH-)=KW | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
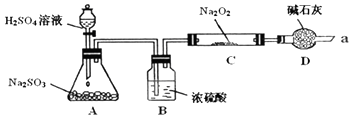
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.