题目内容
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: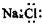 |
D、CO2的分子模型示意图: |
考点:原子核外电子排布,电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.硫离子核外电子数为18,结合能量最低原理书写判断;
B.氮气分子中N原子之间形成3对共用电子对,用短线“-”代替共用电子对即为其结构式,未成键的孤电子对不需要标出;
C.NaCl属于离子化合物,由钠离子与氯离子构成;
D.CO2分子为直线型结构.
B.氮气分子中N原子之间形成3对共用电子对,用短线“-”代替共用电子对即为其结构式,未成键的孤电子对不需要标出;
C.NaCl属于离子化合物,由钠离子与氯离子构成;
D.CO2分子为直线型结构.
解答:
解:A.硫离子核外电子数为18,核外电子排布式:1s22s22p63s23p6,故A正确;
B.N2的结构式为N≡N,故B错误;
C.NaCl属于离子化合物,由钠离子与氯离子构成,其电子式为 ,故C错误;
,故C错误;
D.CO2分子为直线型结构,选项中为V型,与二氧化碳分子结构不符合,故D错误,
故选A.
B.N2的结构式为N≡N,故B错误;
C.NaCl属于离子化合物,由钠离子与氯离子构成,其电子式为
 ,故C错误;
,故C错误;D.CO2分子为直线型结构,选项中为V型,与二氧化碳分子结构不符合,故D错误,
故选A.
点评:本题考查常用化学用语,涉及核外电子排布、结构式、电子式、分子模型,难度不大,侧重对基础知识的巩固.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
下列有关大小关系的判断中,肯定正确的是( )
| A、常温下,将甲酸钠和适量盐酸混合,若所得的溶液恰好呈中性,则粒子间存在大小关系:c(Na+)>c(HCOO-)>c(HCOOH)>c(H+)=c(OH-) |
| B、将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合,若离子间存在大小关系:c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则有:a<b |
| C、若KHA溶液呈酸性,则离子间一定存在大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| D、向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
| A、反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态 |
| B、达平衡后若升高温度,C的浓度将增大 |
| C、达平衡后若增大压强,A的转化率降低 |
| D、4 s内用物质B表示的反应速率为0.075 mol/(L?s) |
将标准状况下a L HCl(g)溶于100g水中,得到的盐酸的密度为b g?cm-3,则该盐酸的物质的量浓度是( )
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
能源是现代物质文明的原动力,与我们每个人息息相关.下列有关能量的理解正确的是( )
| A、利用盐酸与苛性钠的反应,可以制成原电池,将化学能转化为电能 |
| B、化学反应中的能量变化的大小与反应物的质量多少无关 |
| C、化学变化中的能量变化主要是由化学键变化引起的 |
| D、燃料电池的能量转化率可达100% |
下列事实中,不能用来比较主族元素金属性或非金属性强弱的是( )
| A、化合价高低 |
| B、氢化物的稳定性 |
| C、元素在周期表中的位置 |
| D、最高价氧化物对应水化物的酸性或碱性强弱 |
下列反应过程中同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A、H2+CuO
| ||||
| B、2Na2O2+2H2O═4NaOH+O2↑ | ||||
C、2KClO3
| ||||
| D、2NaOH+Cl2═NaCl+NaClO+H2O |
在A+B(s)?C反应中,若增大压强或降低温度,B的转化率均增大,则正确的是( )
| A、A是固体,C是气体,正反应吸热 |
| B、A是气体,C是固体或液体,正反应放热 |
| C、A是气体,C是气体,正反应放热 |
| D、A是气体,C是气体,正反应吸热 |