题目内容
在NaCl、NaOH、Na2O2、N2、H2S、H2O2化合物中,只含有离子键的是 ,既含有离子键又含有非极性键的是 ,既含极性键又含有非极性键的是 ,只含有非极性键的是 .
考点:离子化合物的结构特征与性质,极性键和非极性键
专题:化学键与晶体结构
分析:金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,以此解答该题.
解答:
解:NaCl中钠离子和氯离子之间只存在离子键;
Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;
H2O2中H原子和O原子之间只存在极性共价键,O与O原子之间为非极性键;
N2中N原子之间只存在非极性共价键;
故答案为:NaCl;Na2O2;H2O2;N2.
Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;
H2O2中H原子和O原子之间只存在极性共价键,O与O原子之间为非极性键;
N2中N原子之间只存在非极性共价键;
故答案为:NaCl;Na2O2;H2O2;N2.
点评:本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
有关晶体结构的叙述中,错误的是( )


| A、金刚石的正四面体网状结构中最小的环上有6个碳原子 |
| B、在氯化钠晶体中,每个氯离子周围都紧邻8个钠离子 |
| C、如图在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子 |
| D、分子晶体干冰也是面心立方晶胞,每个晶胞平均含有4个CO2分子 |
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: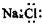 |
D、CO2的分子模型示意图: |
 已知2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: