题目内容
下列反应过程中同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A、H2+CuO
| ||||
| B、2Na2O2+2H2O═4NaOH+O2↑ | ||||
C、2KClO3
| ||||
| D、2NaOH+Cl2═NaCl+NaClO+H2O |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:化学反应的实质为旧键断裂、新键形成,一般来说,活泼金属与非金属形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.
解答:
解:A.没有非极性键和离子键的形成,故A错误;
B.过氧化钠中的离子键、非极性断裂、水中的极性键断裂,且氧气中非极性键形成、氢氧化钠中离子键、极性共价键形成,故B正确;
C.没有非极性键的断裂和极性共价键的形成,故C错误;
D.没有非极性键的形成,故D错误.
故选B.
B.过氧化钠中的离子键、非极性断裂、水中的极性键断裂,且氧气中非极性键形成、氢氧化钠中离子键、极性共价键形成,故B正确;
C.没有非极性键的断裂和极性共价键的形成,故C错误;
D.没有非极性键的形成,故D错误.
故选B.
点评:本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: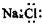 |
D、CO2的分子模型示意图: |
下列反应的离子方程式正确的是( )
| A、乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+2OH-→CH3COO-+CH3CH2O-+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | ||
C、苯酚钠溶液中通入少量二氧化碳:2 +CO2+H2O +CO2+H2O
 +CO32- +CO32- | ||
D、乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-
|
采用不同的分类方法,可将非金属氧化物分为不同的类型.例如从某种意义上可将P2O5、SO2、SO3、Cl2O7等归为一类,则下列氧化物与它们属于同一类的是( )
| A、CO |
| B、NO |
| C、N2O5 |
| D、Na2O |
甲、乙是周期表中同主族相邻的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
| A、x+2 | B、x+10 |
| C、x+18 | D、x+8 |
下列说法正确的是( )
| A、Ca2+的核外电子排布式为1s22s22p63s23p64s2 |
B、铁原子的价电子轨道排布图: |
| C、某原子的核外电子排布式为1s22s22p63s23p63d54s1,则其成单电子数为2 |
| D、各能级的原子轨道数按s,p,d,f的顺序依次为1、3、5、7 |
下列说法正确的是( )
| A、燃烧后能生成CO2和H2O的有机物,一定含有碳、氢、氧三种元素 |
| B、所有烷烃中均有碳碳单键 |
| C、属于同分异构体的物质,其分子式相同,分子量相同;但分子量相同的不同物质不一定是同分异构体 |
| D、分子组成相差一个或几个CH2原子团的物质是同系物 |