题目内容
能源是现代物质文明的原动力,与我们每个人息息相关.下列有关能量的理解正确的是( )
| A、利用盐酸与苛性钠的反应,可以制成原电池,将化学能转化为电能 |
| B、化学反应中的能量变化的大小与反应物的质量多少无关 |
| C、化学变化中的能量变化主要是由化学键变化引起的 |
| D、燃料电池的能量转化率可达100% |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、氧化还原反应是设计成原电池的必须条件;
B、△H的大小与化学计量数对应;
C、化学反应中能量变化是因为旧键断裂新键形成;
D、燃料电池会有部分化学能转化为热能.
B、△H的大小与化学计量数对应;
C、化学反应中能量变化是因为旧键断裂新键形成;
D、燃料电池会有部分化学能转化为热能.
解答:
解:A、酸碱中和反应不是氧化还原反应,不能设计成原电池,故A错误;
B、△H的大小与反应物多少有关,故B错误;
C、化学反应过程就是旧键断裂新键形成过程,断裂化学键和形成化学键需要吸收和释放能量,故C正确;
D、燃料电池会有部分化学能转化为热能,故D错误.
故选:C.
B、△H的大小与反应物多少有关,故B错误;
C、化学反应过程就是旧键断裂新键形成过程,断裂化学键和形成化学键需要吸收和释放能量,故C正确;
D、燃料电池会有部分化学能转化为热能,故D错误.
故选:C.
点评:本题主要考查原电池原理、焓变与化学计量数的关系、化学反应中能量转化的原因、燃料电池的能量转化,题目难度不大.

练习册系列答案
相关题目
一定温度下,某容器内M、N两种物质,其物质的量随时间变化的曲线如图,下列表述中正确的是( )
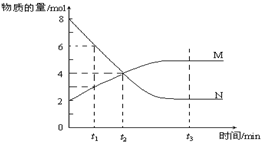

| A、该反应的化学方程式为:N?2M |
| B、t1时,正反应速率大于逆反应速率 |
| C、t2时,正逆反应速率相等,达到平衡 |
| D、t3时,M、N的浓度不再发生变化,反应停止 |
下列实验操作正确的是( )
| A、用分液漏斗分离环己烷和苯的混合液体 |
| B、溴乙烷10%的烧碱溶液中,加热片刻后,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子 |
| C、做银镜反应实验时应将醛溶液和新制备的银氨溶液混合后充分加热至沸腾 |
| D、实验室制溴苯时选用的试剂是浓溴水、苯和铁屑 |
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: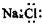 |
D、CO2的分子模型示意图: |
糖类、脂肪和蛋白质是维持人体生命活动所必须的三大营养物质.以下叙述正确的是( )
| A、植物油的主要成分是高级脂肪酸,不能使溴水褪色 |
| B、淀粉、纤维素的组成都可以用(C6H10O5)n表示,二者互为同分异构体 |
| C、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| D、淀粉、油脂、蛋白质都属于高分子化合物 |
下列反应的离子方程式正确的是( )
| A、乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+2OH-→CH3COO-+CH3CH2O-+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | ||
C、苯酚钠溶液中通入少量二氧化碳:2 +CO2+H2O +CO2+H2O
 +CO32- +CO32- | ||
D、乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-
|
甲、乙是周期表中同主族相邻的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
| A、x+2 | B、x+10 |
| C、x+18 | D、x+8 |
在酸性溶液中能大量共存,并且溶液为无色透明的是( )
| A、Na+、K+、Fe2+、NO3- |
| B、NH4+、Na+、NO3-、S2- |
| C、K+、NH4、NO3-、Cl- |
| D、Mg2+、Fe3+、Cl-、OH- |
