题目内容
在A+B(s)?C反应中,若增大压强或降低温度,B的转化率均增大,则正确的是( )
| A、A是固体,C是气体,正反应吸热 |
| B、A是气体,C是固体或液体,正反应放热 |
| C、A是气体,C是气体,正反应放热 |
| D、A是气体,C是气体,正反应吸热 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:依据化学平衡移动原理改变一个条件,平衡向减弱这种改变的方向进行分析,在A+B(s)?C反应中,若增大压强或降低温度,B的转化率均增大,说明平衡正向进行.
解答:
解:A、A是固体,C是气体,增大压强平衡逆向进行,降温平衡正向进行,正反应放热,故A错误;
B、A是气体,C是固体或液体,A(g)+B(s)?C(l),增大压强平衡正向进行,降温平衡正向进行,正反应放热,故B正确;
C、A是气体,C是气体,A(g)+B(s)?C(g),增大压强平衡不动,降温平衡正向进行,正反应放热,故C错误;
D、A是气体,C是气体,A(g)+B(s)?C(g),增大压强平衡不动,降温平衡正向进行,正反应放热,故D错误;
故选B.
B、A是气体,C是固体或液体,A(g)+B(s)?C(l),增大压强平衡正向进行,降温平衡正向进行,正反应放热,故B正确;
C、A是气体,C是气体,A(g)+B(s)?C(g),增大压强平衡不动,降温平衡正向进行,正反应放热,故C错误;
D、A是气体,C是气体,A(g)+B(s)?C(g),增大压强平衡不动,降温平衡正向进行,正反应放热,故D错误;
故选B.
点评:本题考查了化学平衡移动原理的分析判断,反应特征和平衡原理的理解应用是解题关键,题目难度中等.

练习册系列答案
相关题目
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: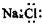 |
D、CO2的分子模型示意图: |
下列说法正确的是( )
| A、Ca2+的核外电子排布式为1s22s22p63s23p64s2 |
B、铁原子的价电子轨道排布图: |
| C、某原子的核外电子排布式为1s22s22p63s23p63d54s1,则其成单电子数为2 |
| D、各能级的原子轨道数按s,p,d,f的顺序依次为1、3、5、7 |
下表是几种物质在指定温度下的溶解度(g).现将相同物质的量的NaCl、CO2、NH3在30℃时制成溶液,此时溶液中无晶体,当降温至某温度时,开始析出晶体,此晶体是( )
| 温度 | 0℃ | 10℃ | 20℃ | 30℃ |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.1 |
| NH4HCO3 | 11.9 | 15.9 | 21.0 | 27.0 |
| NaHCO3 | 6.9 | 8.15 | 9.6 | 11.1 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 |
| A、NH4Cl |
| B、NH4HCO3 |
| C、NaHCO3 |
| D、NaCl |
在酸性溶液中能大量共存,并且溶液为无色透明的是( )
| A、Na+、K+、Fe2+、NO3- |
| B、NH4+、Na+、NO3-、S2- |
| C、K+、NH4、NO3-、Cl- |
| D、Mg2+、Fe3+、Cl-、OH- |
在一密闭的容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积扩大一倍,当达到新平衡时B的浓度是原来的40%则( )
| A、平衡向正反应方向移动 |
| B、A的转化率增大了 |
| C、a<b |
| D、B的质量分数减少了 |
下列说法正确的是( )
| A、燃烧后能生成CO2和H2O的有机物,一定含有碳、氢、氧三种元素 |
| B、所有烷烃中均有碳碳单键 |
| C、属于同分异构体的物质,其分子式相同,分子量相同;但分子量相同的不同物质不一定是同分异构体 |
| D、分子组成相差一个或几个CH2原子团的物质是同系物 |
α鸢尾酮香料的分子结构如图所示,下列说法中不正确的是( )


| A、α鸢尾酮可与某种酚互为同分异构体 |
| B、1 mol α鸢尾酮最多可与3 mol H2加成 |
| C、α鸢尾酮能发生银镜反应 |
D、α鸢尾酮经加氢→消去→加氢可转变为 |