题目内容
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
| A、反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态 |
| B、达平衡后若升高温度,C的浓度将增大 |
| C、达平衡后若增大压强,A的转化率降低 |
| D、4 s内用物质B表示的反应速率为0.075 mol/(L?s) |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:A、当同一物质的正逆反应速率相等时,该反应达到平衡状态.
B、升高温度平衡向吸热方向移动,从而确定C的浓度变化;
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化.
D、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率.
B、升高温度平衡向吸热方向移动,从而确定C的浓度变化;
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化.
D、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率.
解答:
解:A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故A错误.
B、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故B错误;
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,故C错误.
D、C的浓度为0.6mol?L-1,则C的反应速率是0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol?L-1?S-1,故D正确.
故选D.
B、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故B错误;
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,故C错误.
D、C的浓度为0.6mol?L-1,则C的反应速率是0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol?L-1?S-1,故D正确.
故选D.
点评:本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定温度下,某容器内M、N两种物质,其物质的量随时间变化的曲线如图,下列表述中正确的是( )
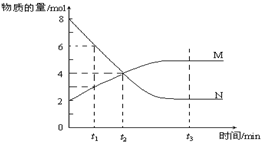

| A、该反应的化学方程式为:N?2M |
| B、t1时,正反应速率大于逆反应速率 |
| C、t2时,正逆反应速率相等,达到平衡 |
| D、t3时,M、N的浓度不再发生变化,反应停止 |
下列叙述正确的是( )
| A、丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B、氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C、实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D、测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
下列实验操作正确的是( )
| A、用分液漏斗分离环己烷和苯的混合液体 |
| B、溴乙烷10%的烧碱溶液中,加热片刻后,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子 |
| C、做银镜反应实验时应将醛溶液和新制备的银氨溶液混合后充分加热至沸腾 |
| D、实验室制溴苯时选用的试剂是浓溴水、苯和铁屑 |
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: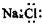 |
D、CO2的分子模型示意图: |
下列反应的离子方程式正确的是( )
| A、乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+2OH-→CH3COO-+CH3CH2O-+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | ||
C、苯酚钠溶液中通入少量二氧化碳:2 +CO2+H2O +CO2+H2O
 +CO32- +CO32- | ||
D、乙醛溶液与足量的银氨溶液共热:CH3CHO+2[Ag(NH3)2]++2OH-
|
下列说法正确的是( )
| A、Ca2+的核外电子排布式为1s22s22p63s23p64s2 |
B、铁原子的价电子轨道排布图: |
| C、某原子的核外电子排布式为1s22s22p63s23p63d54s1,则其成单电子数为2 |
| D、各能级的原子轨道数按s,p,d,f的顺序依次为1、3、5、7 |