题目内容
将标准状况下a L HCl(g)溶于100g水中,得到的盐酸的密度为b g?cm-3,则该盐酸的物质的量浓度是( )
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=
计算氯化氢的物质的量,再根据m=nM计算氯化氢质量,溶液的质量=100g+m(HCl),根据V=
计算溶液的体积,根据物质的量浓度公式c=
计算溶液的物质的量浓度.
| V |
| Vm |
| m |
| ρ |
| n |
| V |
解答:
解:标准状况下的aL HCl(气)的物质的量为
=
mol.
氯化氢的质量为
mol×36.5g/mol=
g.
所以溶液质量为100g+
g=(100+
)g.
所以溶液的体积为
=
L.
所以溶液浓度为
=
mol/L.
故选D.
| a L |
| 22.4L/mol |
| a |
| 22.4 |
氯化氢的质量为
| a |
| 22.4 |
| 36.5a |
| 22.4 |
所以溶液质量为100g+
| 36.5a |
| 22.4 |
| 36.5a |
| 22.4 |
所以溶液的体积为
(100+
| ||
| 1000b g/L |
| 2240+36.5a |
| 22400b |
所以溶液浓度为
| ||
|
| 1000ab |
| 2240+36.5a |
故选D.
点评:本题考查物质的量浓度的相关计算与理解,难度不大,正确计算溶液的体积是解本题的关键,注意不能把溶剂的体积当做溶液的体积,也可以先计算质量分数,再利用c=
计算.
| 1000ρw |
| M |

练习册系列答案
相关题目
下列叙述正确的是( )
| A、丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B、氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C、实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D、测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断错误的是( )


| A、若D为CO,C能和E反应,则A一定不是单质 |
| B、若X是Na2CO3,C为CO2,则A一定是氯气,且D和E不反应 |
| C、若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E是一种清洁的能源 |
| D、若C的相对分子质量比D小16,B可以使紫色石蕊试液变色,则D一定能与冷水反应 |
下列各项中表达正确的是( )
| A、硫离子的核外电子排布式:1s22s22p63s23p6 |
| B、N2的结构式::N≡N: |
C、NaCl的电子式: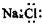 |
D、CO2的分子模型示意图: |
下列叙述正确的是( )
| A、烃的组成均符合通式CnH2n+2 |
| B、石油裂化是化学变化 |
| C、甲烷在烷烃同系物中含碳量最高,因而是清洁能源 |
| D、甲烷只能发生取代反应 |
采用不同的分类方法,可将非金属氧化物分为不同的类型.例如从某种意义上可将P2O5、SO2、SO3、Cl2O7等归为一类,则下列氧化物与它们属于同一类的是( )
| A、CO |
| B、NO |
| C、N2O5 |
| D、Na2O |