题目内容
3.下列物质的性质与应用的对应关系正确的是( )| A. | MgO的熔点很高,可用于制造耐火材料 | |
| B. | (NH4)2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒 | |
| C. | 常温下Al与浓硝酸不反应,可以用铝槽车运输浓硝酸 | |
| D. | 碳具有强还原性,高温下能将二氧化硅还原为硅 |
分析 A.耐火材料应具有较高的熔点;
B.铵盐能够使蛋白质发生盐析,不会发生变性;
C.依据浓硝酸的强氧化性解答;
D.依据碳与二氧化硅高温下反应生成硅和一氧化碳解答.
解答 解:A.MgO的熔点很高,所以可用于制造耐火材料,故A正确;
B.(NH4)2SO4浓溶液能使蛋白质溶液发生盐析,不会发生变性,不能用于杀菌消毒,故B错误;
C.浓硝酸具有强的氧化性,常温下能够使铝钝化,所以常温下可以用铝槽车运输浓硝酸,故C错误;
D.碳与二氧化硅高温下反应生成硅和一氧化碳,工业上用此反应制备粗硅,故D正确;
故选:AD.
点评 本题涉及氧化镁、蛋白质、浓硝酸、碳等物质的性质考查,熟悉相关物质的性质是解题关键,注意蛋白质的盐析与变性的区别,注意知识的归纳和整理,难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 少量AlCl3溶液滴入过量的NaOH溶液中:Al3++4OH-=AlO2-+2H2O | |
| B. | 将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ | |
| C. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 氯气溶解于水:Cl2+H2O?2H++Cl-+ClO- |
14.下列对Na2O和Na2O2的叙述正确的是( )
| A. | 都是白色固体 | B. | 都是强氧化剂 | ||
| C. | 与酸反应的生成物都是盐和水 | D. | 都能与水反应形成强碱溶液 |
11.下列说法中,正确的是( )
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 14g N2含有的分子数为0.5NA | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
18.NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的酸性增强 | |
| C. | 该反应中NO2-被还原 | |
| D. | H+可以是盐酸 |
6.下列离子方程式正确的是( )
| A. | 硫酸铝溶液与过量Ba(OH)2溶液反应2Al3++3SO42-+3 Ba2++8OH-═3BaSO4↓+2A1O2-+4H2O | |
| B. | 碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+═CO2↑+H2O | |
| C. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++6H2O+02↑ | |
| D. | 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O═2Cl-+SO2↑+2HClO |
3.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | 含D的盐溶液一定显酸性 | |
| B. | 可电解熔融DE3冶炼D单质 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 1 mol 由元素A、B组成的化合物可能含有18 mol e- |
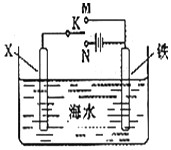 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.