题目内容
4.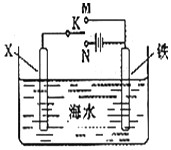 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
分析 为减缓铁的腐蚀,如果用铁和比铁活泼的金属作电极,可以将其设计成原电池,如果用铁和碳作电极材料,则铁棒必须作电解池的阴极,该保护法的名称是外加电流的阴极保护法,溶液中阳离子向阴极移动,阴离子向阳极移动.
解答 解:电极材料是铁和碳棒,铁比碳活泼,所以为减缓铁的腐蚀,必须将其设计成电解池即开关K应该置于N,且铁作阴极,碳棒作阳极,该保护法的名称是外加电流的阴极保护法,溶液中阴离子向阳极即X极移动;
故答案为:N;X;牺牲阳极的阴极保护法.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理即可解答,难度不大.

练习册系列答案
相关题目
3.下列物质的性质与应用的对应关系正确的是( )
| A. | MgO的熔点很高,可用于制造耐火材料 | |
| B. | (NH4)2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒 | |
| C. | 常温下Al与浓硝酸不反应,可以用铝槽车运输浓硝酸 | |
| D. | 碳具有强还原性,高温下能将二氧化硅还原为硅 |
15.物质的用途体现性质.下列有关物质的用途和性质的说法中正确的是( )
| A. | 烧碱可以中和酸性土壤--烧碱显碱性 | |
| B. | 氮气可充入食品包装袋中防腐--氮气化学性质稳定 | |
| C. | 洗涤剂能清洗油污--洗涤剂能溶解油污 | |
| D. | 干冰可用于人工降雨--干冰升华放出热量 |
16.能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol;
③C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/moL;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)=CH4(g)+2O2(g)△H=+802kJ/moL
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol
(2)计算C(s)+H2O(g)?H2(g)+CO(g)△H=+131.5 kJ/moL;
(3)估算出C=O键能为800kJ/moL.
(4)CH4的燃烧热△H=-890 kJ/moL.
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为0.56mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g•℃)].
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol;
③C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/moL;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ/moL;
⑤CO2(g)+2H2O(g)=CH4(g)+2O2(g)△H=+802kJ/moL
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
(1)写出能表示H2燃烧热的热化学方程式:H2(g)+0.5 O2(g)=H2O(l)△H=-286kJ/mol
(2)计算C(s)+H2O(g)?H2(g)+CO(g)△H=+131.5 kJ/moL;
(3)估算出C=O键能为800kJ/moL.
(4)CH4的燃烧热△H=-890 kJ/moL.
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为0.56mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g•℃)].
14.设NA为阿伏伽德罗常数的值,下列有关其说法正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 在常温和常压下,22gCO2含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在同温、同压下,相同体积的任何气体,所含分子数相同 |