题目内容
8.FeSO4的酸性溶液分别被①氯水②过氧化氢③MnO4-氧化的离子方程式为:①2Fe2++Cl2=2Fe3++2Cl-;
②2Fe2++H2O2+2H+=2Fe3++2H2O
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
分析 ①FeSO4的酸性溶液中加氯水与氯气发生氧化还原反应生成三价铁离子;
②FeSO4的酸性溶液中加双氧水发生氧化还原反应生成三价铁离子;
③FeSO4的酸性溶液中加MnO4-发生氧化还原反应生成三价铁离子和二价锰离子.
解答 解:①FeSO4的酸性溶液中加氯水与氯气发生氧化还原反应生成三价铁离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;故答案为:2Fe2++Cl2=2Fe3++2Cl-;
②FeSO4的酸性溶液中加双氧水发生氧化还原反应生成三价铁离子,离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③FeSO4的酸性溶液中加MnO4-发生氧化还原反应生成三价铁离子和二价锰离子,离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
点评 本题考查了离子方程式的书写,明确氧化还原反应的实质是解题关键,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
18.化学在生活中有着广泛的应用,下列对应关系错误的是( )
| 选项 | 性质 | 实际应用 |
| A | SO2具有漂白性 | SO2可用于食品增白 |
| B | SiO2熔点高 | SiO2可用于制作耐高温仪器 |
| C | Al(OH)3具有弱碱性 | Al(OH)3可用于制胃酸中和剂 |
| D | Fe3+具有氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| A. | A | B. | B | C. | C | D. | D |
16.下列物质中,与盐酸、氢氧化钠溶液均能反应,且都生成氢气的是( )
| A. | Al2O3 | B. | Fe | C. | Al | D. | (NH4)2CO3 |
3.下列物质的性质与应用的对应关系正确的是( )
| A. | MgO的熔点很高,可用于制造耐火材料 | |
| B. | (NH4)2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒 | |
| C. | 常温下Al与浓硝酸不反应,可以用铝槽车运输浓硝酸 | |
| D. | 碳具有强还原性,高温下能将二氧化硅还原为硅 |
11.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有的Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
8.在含有0.4mol HNO3和0.2molHCl的混合酸1L中,加入0.3mol铜粉微热,充分反应后溶液中Cu2+的物质的量为( )
| A. | 0.15mol | B. | 0.225mol | C. | 0.3mol | D. | 无法计算 |




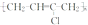 ).
).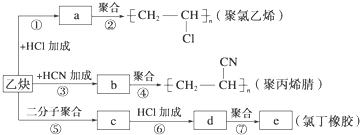
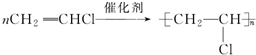 ;
; ;
;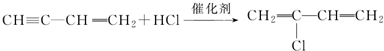 ;
;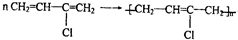 .
.