题目内容
11.下列说法中,正确的是( )| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 14g N2含有的分子数为0.5NA | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
分析 A.摩尔质量单位为g/mol;
B.气体摩尔体积使用对象为气体;
C.依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$解答;
D.溶液体积未知.
解答 解:A.SO2的摩尔质量是64 g/mol,故A错误;
B.标况下,水是液体,不能使用气体摩尔体积,故B错误;
C.14g N2含有的分子数为$\frac{14g}{28g/mol}$×NA=0.5NA,故C正确;
D.溶液体积未知,无法计算氯离子数目,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,质量换算物质的量计算微粒数,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
2.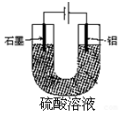 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A. | 阳极电极方程式为Al-3e+6OH-=Al2O3+3H2O | |
| B. | 随着电解的进行,溶液的pH逐渐增大 | |
| C. | 当阴极生成气体3.36L(标况)时,阳极增重2.4g | |
| D. | 电解过程中H+移向Al电极 |
6.由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知硫元素的质量分数w(S)=a%,则氧元素的质量分数w(O)为( )
| A. | 1.75a% | B. | 1.25a% | C. | 1-1.75a% | D. | 1-1.25a% |
16.下列物质中,与盐酸、氢氧化钠溶液均能反应,且都生成氢气的是( )
| A. | Al2O3 | B. | Fe | C. | Al | D. | (NH4)2CO3 |
3.下列物质的性质与应用的对应关系正确的是( )
| A. | MgO的熔点很高,可用于制造耐火材料 | |
| B. | (NH4)2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒 | |
| C. | 常温下Al与浓硝酸不反应,可以用铝槽车运输浓硝酸 | |
| D. | 碳具有强还原性,高温下能将二氧化硅还原为硅 |
11.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有的Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
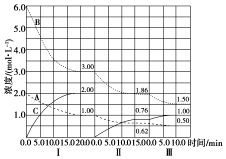 已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:
已知某放热热反应在1L的密闭容器中进行反应.保持容器体积不变,改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各气体物质浓度随时间变化的曲线如图所示:


