题目内容
12.将铜和氧化铁的混和物溶于足量稀盐酸,再向所得溶液滴入2滴 KSCN溶液后出现红色.下列有关说法错误的是( )| A. | 容器中可能有固体残渣 | B. | 所得溶液中存在Fe2+、Fe3+、Cu2+ | ||
| C. | 原固体中n(Fe2O3)>n(Cu) | D. | 再加入铜后,溶液红色逐渐褪去 |
分析 将铜和氧化铁的混和物溶于足量稀盐酸中,发生反应Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2,向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜一定全部溶解,生成氯化铜,部分铁元素变化为亚铁盐,据此分析.
解答 解:将铜和氧化铁的混和物溶于足量稀盐酸中,发生反应Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2,向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜在溶液中一定全部溶解,生成氯化铜,部分铁元素变化为亚铁盐,
A.氧化铁溶于过量的稀盐酸,生成的氯化铁过量铜全部溶解,容器中不可能有固体残渣,故A错误;
B.向所得溶液中滴入2滴KSCN溶液后出现红色,说明铁离子过量,铜在溶液中一定全部溶解,生成氯化铜,部分铁元素变化为亚铁盐,所以溶液中存在Fe2+、Fe3+、Cu2+,故B正确;
C.将铜和氧化铁的混和物溶于足量稀盐酸中,发生反应Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Cu=2FeCl2+CuCl2,滴入2滴KSCN溶液后出现红色,说明铁离子过量,所以原固体中n(Fe2O3)>n(Cu),故C正确;
D.分析可知铁离子过量,向所得溶液中滴入2滴KSCN溶液后出现红色,Fe3++3SCN-?Fe(SCN)3,加入铜发生反应2FeCl3+Cu=2FeCl2+CuCl2,Fe3++3SCN-?Fe(SCN)3,平衡逆向进行,铁离子消失后溶液红色褪去,故D正确;
故选A.
点评 本题考查了铁及其化合物性质的分析应用,主要是反应顺序和反应产物的判断,注意能反应的不能共存,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
3.下列由实验现象得出的结论正确的是( )
| 逸項 | 实驗操作及现象 | 实验结论 |
| A | 向某溶洧液中同时滴加几滴KSCN溶液和少量的新制氯水,溶液变成血红色 | 该溶液中一定含有Fe3+ |
| B | 将澄清石灰水滴入可能混有Na2CO3的 NaHCO3溶液中出现白色沉淀 | 该液中一定含有Na2CO3 |
| C | 常温下,用pH计测定某溶液NaHSO3溶液的 pH约为5.20 | 该溶液中HSO3-的电离程度大于它的水解程度 |
| D | 常温下,向某溶液中滴加稀NaOH溶液将湿润的红石蕊试纸置于试管口,试纸不变蓝 | 该溶液中一定不含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
20.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 与12C互为同素异形体的14C可用于文物年代的鉴定 | |
| B. | 从海水中提取物质不一定都要通过化学反应实现 | |
| C. | 为避免核泄漏事故的危害,应推广燃煤发电,停建核电站 | |
| D. | 淀粉、油脂、蛋白质等都是天然高分子化合物 |
7.有关0.1mol/LNa2SO3溶液的说法正确的是( )
| A. | 由于水解,溶液中n(SO32-)<0.1mol | |
| B. | 加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) | |
| D. | 2c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
17.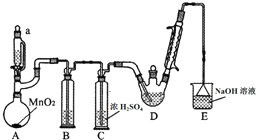 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH (三氯乙酸)+HCl
②相关物质的部分物理性质:
(1)装置B中盛放的试剂是饱和食盐水;装置E的作用是吸收多余氯气和氯化氢;
(2)若撤去装置C,可能导致装置D中副产物Cl3CCOOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,可采用蒸馏的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有蒸馏烧瓶、冷凝管.
(4)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol/L碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200mol/LNa2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(保留3位有效数字)
滴定的反应原理:
CCl3CHO+OH-→CHCl3+HCOO-
HCOO-+I2→H++2I-+CO2↑
I2+2S2O32-→2I-+S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH (三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物Cl3CCOOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,可采用蒸馏的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有蒸馏烧瓶、冷凝管.
(4)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol/L碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200mol/LNa2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(保留3位有效数字)
滴定的反应原理:
CCl3CHO+OH-→CHCl3+HCOO-
HCOO-+I2→H++2I-+CO2↑
I2+2S2O32-→2I-+S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L SO3 中所含分子数为NA | |
| B. | 含1mol硅原子的SiO2晶体中Si-O键的个数为4NA | |
| C. | 10L PH=1的硫酸溶液中含有的H+离子数为2NA | |
| D. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA |
1. NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
 NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )| A. | a点的溶液中:c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-) | |
| B. | b点的溶液中:c(Na+)=c(SO42-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | c点的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | d、e点对应溶液中,水电离程度大小关系是d>e |
2. 以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )
 以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )| A. | b电极为负极,发生氧化反应 | |
| B. | a电极发生的反应为N2+8H++6e-=2NH4+ | |
| C. | A溶液中所含溶质为NH4Cl | |
| D. | 当反应消耗1molN2时,则消耗的H2为67.2L |
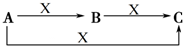 A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题:
A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题: