题目内容
2.下列有关叙述正确的是( )| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
分析 A.非金属元素可形成阴离子,如氯离子、碳酸根离子等,也可以形成阳离子,如铵根离子;
B.金属元素可以形成阴离子,如偏铝酸根离子、高锰酸根离子等;
C.同分异构体之间分子式相同,但是化学性质不同;
D.氢离子为单核阳离子,其核外电子数为0.
解答 解:A.非金属元素既可以形成阴离子,如氯离子、碳酸根离子、硫酸根离子等,也可以形成阳离子,如铵根离子,故A正确;
B.金属元素形成的离子不一定为阳离子,如高锰酸根离子、偏铝酸根离子、重铬酸跟离子等,故B错误;
C.分子式相同的物质,如果结构不同,则化学性质不同,如互为同分异构体的化合物之间,故C错误;
D.单核阳离子,其最外层不一定具有2电子或8电子的结构,如氢离子的核外电子为0,故D错误;
故选A.
点评 本题考查较为综合,涉及核外电子排布、阴阳离子类型与原子结构的关系、结构与性质的关系等知识,题目难度中等,注意掌握原子核外电子排布特点,明确离子类型与元素类型的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
12.巴豆酸的结构简式为CH3-CH═CH-COOH.现有下列物质,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸性KMnO4溶液.
①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸性KMnO4溶液.
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 24g二氧化硅晶体中含有SiO2分子数为0.4NA | |
| D. | 5.6g Fe与含0.2mol HNO3的溶液充分反应,至少失去电子数为0.2NA |
17.海洋资源有巨大的开发潜力,人类正着力进行海水的综合利用.
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:
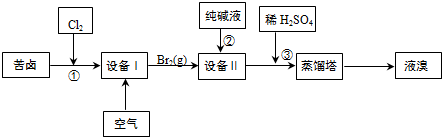
①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:
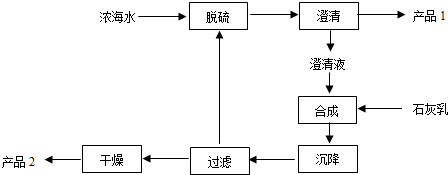
浓海水中的离子浓度如下:
产品1是脱硫阶段产生的沉淀,其主要成分的化学式为CaSO4,1L浓海水最多可得到产品2的质量为69.6g.
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:

①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:

浓海水中的离子浓度如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
7.有关0.1mol/LNa2SO3溶液的说法正确的是( )
| A. | 由于水解,溶液中n(SO32-)<0.1mol | |
| B. | 加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) | |
| D. | 2c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
14.下列反应可用离子反应方程式2Ca2++3HCO3-+3OH-→2CaCO3↓+CO32-+3H2O表示的是( )
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
11.化学反应常常伴随能量的变化,以下是 H2与Cl2反应的能量变化示意图
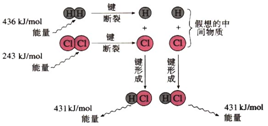
H2(g)+Cl2(g)═2HCl(g)反应的能量变化示意图
下列说法正确的是( )

H2(g)+Cl2(g)═2HCl(g)反应的能量变化示意图
下列说法正确的是( )
| A. | 氯化氢分子的电子式: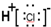 | |
| B. | 该反应是工业制取盐酸的化学反应原理 | |
| C. | 形成1molH-Cl键要吸收431 kJ的能量 | |
| D. | 该反应中反应物总能量小于生成物总能量 |
12. 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
(1)基态乙原子,最外层有2个未成对电子,电子云形状有2种.
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
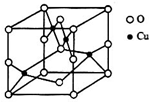
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题: