题目内容
18.硼酸(H3BO3)微溶于水,其水溶液显弱酸性,对人体的受伤组织有防腐作用.工业上以硼镁矿(Mg2B2O5•H2O)为原料生产硼酸,同时以硼镁泥为原料制取硫酸镁,可用于印染、造纸、医药等工业.生产工艺流程如下图所示,请回答下列问题: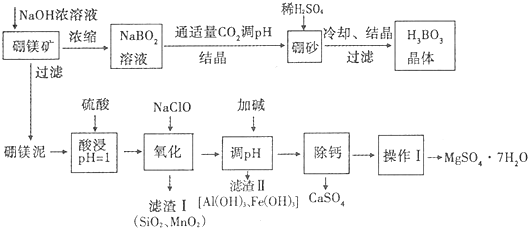
注:
①硼镁泥的主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.
②硼酸电离平衡常数K=5.8×10-10
③
| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(2)硼酸根离子可表示为B(OH)4-.写出硼酸电离的方程式H3BO3+H2O?B(OH)4-+H+
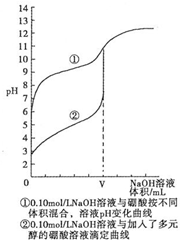
(3)N滴定法测定硼酸晶体的纯度.研究结果表明,用0.1mol•L-1NaOH溶液直接滴定硼酸溶液,滴定过程如曲线①所示,向硼酸溶液中加入多元醇后再滴定如曲线②所示.请分析,能否用强碱直接滴定硼酸溶液,不能 (填“能”或“不能”),理由是:没有明显的pH突变区域,无法判断终点,会造成较大的误差
(4)向硼镁泥酸浸后的溶液中,加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是ClO-+Mn2++H2O=MnO2↓+Cl-+2H+.
(5)加碱调节至pH为4.7时,杂质离子便可完全沉淀.(离子浓度小于或等于1×l0-5mol•L-1时,即可认为该离子沉淀完全)
(6)“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤蒸发浓缩结晶、趁热过滤.
分析 硼镁矿加入氢氧化钠浓溶液,过滤分离,硼镁泥用硫酸酸浸,SiO2不反应,再用NaClO将Mg2+氧化生成MnO2沉淀,过滤分离,滤液中含有硫酸镁、硫酸铝、硫酸铁,加入碱调节溶液pH析出氢氧化铝、氢氧化铁沉淀,过滤分离,除钙后,经过蒸发浓缩、冷却结晶、过滤、洗涤得到硫酸镁晶体.NaBO2溶液通入适量二氧化碳气体得到硼砂,常用稀H2SO4调pH得到H3BO3.
(1)NaBO2溶液与二氧化碳反应得到Na2B4O7,二氧化碳起碳酸作用,同时还生成碳酸盐;
(2)H3BO3与水形成配合物后电离出B(OH)4-与H+;
(3)没有明显的pH突变区域,无法判断终点;
(4)酸性条件下,加入的NaClO可与Mn2+反应产生MnO2沉淀,次氯酸根被还原为氯离子,结合电荷守恒可知有氢离子生成;
(5)加入碱调节溶液pH析出氢氧化铝、氢氧化铁沉淀,氢氧化铝的溶度积较大,完全沉淀时碱性较强,根据氢氧化铝的溶度积计算溶液中OH-浓度,再结合水的离子积计算c(H+),根据pH=-lgc(H+)计算;
(6)硫酸镁与硫酸钙相比,随温度升高,硫酸镁溶解度增大,而硫酸钙溶解度减小,应采取蒸发浓缩结晶出硫酸钙,趁热过滤,减少硫酸镁的损失.
解答 解:硼镁矿加入氢氧化钠浓溶液,过滤分离,硼镁泥用硫酸酸浸,SiO2不反应,再用NaClO将Mg2+氧化生成MnO2沉淀,过滤分离,滤液中含有硫酸镁、硫酸铝、硫酸铁,加入碱调节溶液pH析出氢氧化铝、氢氧化铁沉淀,过滤分离,除钙后,经过蒸发浓缩、冷却结晶、过滤、洗涤得到硫酸镁晶体.NaBO2溶液通入适量二氧化碳气体得到硼砂,常用稀H2SO4调pH得到H3BO3.
(1)NaBO2溶液与二氧化碳反应得到Na2B4O7,二氧化碳起碳酸作用,同时还生成碳酸盐,反应离子方程式为:4BO2-+CO2=B4O72-+CO32-,
故答案为:4BO2-+CO2=B4O72-+CO32-;
(2)H3BO3与水形成配合物后电离出B(OH)4-与H+,电离方程式为:H3BO3+H2O?B(OH)4-+H+,
故答案为:H3BO3+H2O?B(OH)4-+H+;
(3)没有明显的pH突变区域,无法判断终点,会造成较大的误差,不能用强碱直接滴定硼酸溶液,
故答案为:不能;没有明显的pH突变区域,无法判断终点,会造成较大的误差;
(4)酸性条件下,加入的NaClO可与Mn2+反应产生MnO2沉淀,次氯酸根被还原为氯离子,结合电荷守恒可知有氢离子生成,该反应的离子方程式是:ClO-+Mn2++H2O=MnO2↓+Cl-+2H+,
故答案为:ClO-+Mn2++H2O=MnO2↓+Cl-+2H+;
(5)加入碱调节溶液pH析出氢氧化铝、氢氧化铁沉淀,氢氧化铝的溶度积较大,完全沉淀时碱性较强,铝离子沉淀完全时,溶液中c(OH-)=$\root{3}{\frac{1{0}^{-33}}{1×1{0}^{-5}}}$mol/L,则溶液pH=-lg$\frac{1{0}^{-14}}{\root{3}{\frac{1{0}^{-33}}{1×1{0}^{-5}}}}$≈4.7,
故答案为:4.7;
(6)硫酸镁与硫酸钙相比,随温度升高,硫酸镁溶解度增大,而硫酸钙溶解度减小,应采取蒸发浓缩结晶出硫酸钙,趁热过滤,减少硫酸镁析出而导致的损失,
故答案为:蒸发浓缩结晶、趁热过滤.
点评 本题考查物质制备工艺流程,涉及陌生方程式的书写、中和滴定、对条件控制、物质的分离提纯等,侧重考查学生对知识的迁移运用,是高考常考题型,题目素材多来自课外,容易使学生产生畏惧心理,属于易错题目.

| A. | 无机盐 | B. | 油脂 | C. | 水 | D. | 蛋白质 |
| A. | 用乙醚从黄花蒿中提取青蒿素 | B. | 由青蒿素( )合成双氢青蒿素( )合成双氢青蒿素( )的反应 )的反应 | ||
| C. | 空气净化器过滤净化空气 | D. | 消毒柜通电产生臭氧的过程 |
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | 非金属性:Z>W | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
| A. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 24g二氧化硅晶体中含有SiO2分子数为0.4NA | |
| D. | 5.6g Fe与含0.2mol HNO3的溶液充分反应,至少失去电子数为0.2NA |
| 逸項 | 实驗操作及现象 | 实验结论 |
| A | 向某溶洧液中同时滴加几滴KSCN溶液和少量的新制氯水,溶液变成血红色 | 该溶液中一定含有Fe3+ |
| B | 将澄清石灰水滴入可能混有Na2CO3的 NaHCO3溶液中出现白色沉淀 | 该液中一定含有Na2CO3 |
| C | 常温下,用pH计测定某溶液NaHSO3溶液的 pH约为5.20 | 该溶液中HSO3-的电离程度大于它的水解程度 |
| D | 常温下,向某溶液中滴加稀NaOH溶液将湿润的红石蕊试纸置于试管口,试纸不变蓝 | 该溶液中一定不含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 由于水解,溶液中n(SO32-)<0.1mol | |
| B. | 加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-) | |
| D. | 2c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
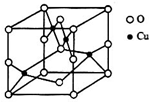 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题: