题目内容
16.下列叙述正确的是(设NA为阿伏加德罗常数的数值)( )| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
分析 A、当溶液中含有的是Fe3+时,滴加氯水,再滴加KSCN溶液也会出现变红的现象;
B、NO2气体中存在平衡:2NO2?N2O4;
C、Kw只受温度的影响;
D、5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl中银元素的价态由0价升高为+1价.
解答 解:A、当溶液中含有的是Fe3+时,滴加氯水、再滴加KSCN溶液也会出现变红的现象,故先滴加氯水、再滴加KSCN溶液无法确定溶液中是Fe3+还是Fe2+,故A错误;
B、NO2气体中存在平衡:2NO2?N2O4,故标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数小于NA,故B错误;
C、Na2CO3溶液加水稀释后,溶液中氢氧根的浓度降低,故pH减小,但Kw只受温度的影响,温度不变,故pH不变,故C错误;
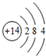
D、5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl中银元素的价态由0价升高为+1价,故反应转移2mol电子,生成1molNa2Mn5O10,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
10.在体积为V L的密闭容器中通入a mol NO和b mol O2,反应后容器中氮原子数和氧原子数之比为( )
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{b}{a}$ |
11.下列叙述正确的是( )
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用无色广口玻璃瓶保存氨水 | ||
| C. | 稀硝酸可除去试管内壁粘有的硫磺 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
1.过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域.湿法工艺制取过氧化尿素是用低浓度的双氧水和饱和尿素溶液在一定条件下合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2$\frac{\underline{\;30℃\;}}{\;}$CO(NH2)2•H2O2△H<0.过氧化尿素的部分性质如下:
湿法合成过氧化尿素的流程图如下:
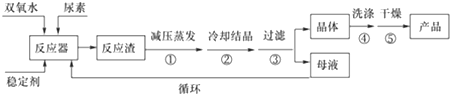
请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单 (答出一点即可),
干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂;技术条件苛刻;产品稳定性差;产品污染不纯等 (答出两点即可),
湿法工艺的优点是:低浓度双氧水,经济效益高;设备简单易于达到;能耗低;产品稳定性好;母液可循环使用等 (答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1 H2SO4,用0.1000mol•L-1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3% (结果保留到小数点后一位).
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单 (答出一点即可),
干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂;技术条件苛刻;产品稳定性差;产品污染不纯等 (答出两点即可),
湿法工艺的优点是:低浓度双氧水,经济效益高;设备简单易于达到;能耗低;产品稳定性好;母液可循环使用等 (答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1 H2SO4,用0.1000mol•L-1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3% (结果保留到小数点后一位).
5.下列关于某些离子的检验及结论,一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
6. 如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
 如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )| A. | 甲、丙 | B. | 乙、丙 | C. | 甲、丁 | D. | 乙、丁 |
 .
.