题目内容
8.(1)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出a kJ的热量,写出该反应中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0.若该反应在绝热、恒容的密闭体系中进行,如图示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

分析 (1)中和热是强酸强碱发生反应生成1mol水放出的热量,据此书写热化学方程式,1mol的稀硫酸含有2molH+,全部反应生成2mol水,由此分析解答;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,1mol的稀硫酸含有2molH+,全部反应生成2mol水,生成1mol水放热$\frac{a}{2}$KJ,中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol;
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol;
A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;
B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确;
C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;
D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确;
故选BD.
点评 本题考查了中和热的热化学方程式的书写、化学平衡状态的判断知识,较基础,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
2.一定条件下,可逆反应N2+3H2═2NH3△H<0 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
3.Na、Cu、C、P、Cl是常见的五种元素.
(1)P原子的最外层电子数为5.
(2)用“>”或“<”填空:
(3)CuCl与O2反应生成CuCl2和一种黑色固体,该反应的化学方程式是4CuCl+O2=2CuCl2+2CuO.
(4)P的最高价氧化物对应的水化物与Na的最高价氧化物对应的水化物反应最多能生成3种盐.
(5)Cl2O为国际公认的高效安全灭菌消毒剂之一,工业上可用Cl2通入Na2CO3溶液制取,同时生成一种食品中的膨松剂,写出该反应的离子方程式2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O.
(1)P原子的最外层电子数为5.
(2)用“>”或“<”填空:
| 离子半径 | 熔点 | 酸性 |
| Cl- >Na+ | NaCl <C(金刚石) | H3PO4 <HClO4 |
(4)P的最高价氧化物对应的水化物与Na的最高价氧化物对应的水化物反应最多能生成3种盐.
(5)Cl2O为国际公认的高效安全灭菌消毒剂之一,工业上可用Cl2通入Na2CO3溶液制取,同时生成一种食品中的膨松剂,写出该反应的离子方程式2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O.
16.下列叙述正确的是(设NA为阿伏加德罗常数的数值)( )
| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
3.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为NA | |
| B. | 1molNa2O2固体中含阴离子总数为2NA | |
| C. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| D. | 100mL12mol•L-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA |
13.下列有关表述正确的是( )
| A. | 次氯酸的电子式: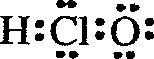 | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: |
20.n g CO2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
| A. | 22m/n mol-1 | B. | m/22n mol-1 | C. | n/32m mol-1 | D. | n/32mmol-1 |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
18.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | Na2S | B. | Cl2 | C. | CO2 | D. | NaHCO3 |