题目内容
5.下列关于某些离子的检验及结论,一定正确的是( )| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
分析 A.可能含有HCO3-;
B.能使湿润的红色石蕊试纸变蓝的气体为氨气;
C.可能生成AgCl沉淀;
D.生成的沉淀不一定为CaCO3.
解答 解:A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,该气体可能为二氧化硫或二氧化碳,原溶液中可能含有SO32-或HSO3-、HCO3-,故A错误;
B.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定存在NH4+,故B正确;
C.溶液不一定含有硫酸根,也可能含有银离子,形成氯化银白色沉淀,故C错误;
D.碳酸钠能与含可溶性钙离子或钡离子的物质结合生成沉淀,故D错误;
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,注意检验离子存在时,需要排除干扰,确保检验方案的严密性,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
16.下列叙述正确的是(设NA为阿伏加德罗常数的数值)( )
| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
13.下列有关表述正确的是( )
| A. | 次氯酸的电子式: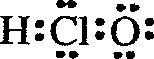 | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: |
20.n g CO2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
| A. | 22m/n mol-1 | B. | m/22n mol-1 | C. | n/32m mol-1 | D. | n/32mmol-1 |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
14.下列事实,其中不能用平衡移动原理解释的是( )
| A. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| B. | 在恒容密闭容器中充入一定量NO2建立2NO2(g)═N2O4(g)△H<0 平衡后,升高温度,体系颜色加深 | |
| C. | 向水中投入金属Na,最终溶液呈碱性 | |
| D. | FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
15.钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2-→2Al(OH)3↓+Na2CO2+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出实验①②③所用氢氧化钠的组成结论.
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2-→2Al(OH)3↓+Na2CO2+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |

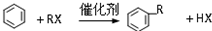 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;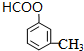 、
、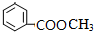 ;
;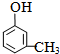 .
.