题目内容
11.有A、B、C、D、E五种元素,它们的核电荷数按C、A、B、D、E的顺序依次增大,C、D都能分别与A按1:1和2:1形成化合物;CB可与EA2反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍,则:(1)A、B、C、D、E这五种元素的名称是氧、氟、氢、钠、硅.
(2)E的原子结构示意图为
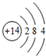 .
.(3)D2A2的化学式为Na2O2.
(4)写出D单质与铜盐溶液反应的离子方程式2Na+Cu2++2H2O=Cu(OH)2↓+H2↑+2Na+.
分析 有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大.E的M层电子数是K层电子数的2倍,则M层电子数为4,故E为Si;气态物质EB4中B表现-1价,结合原子序数可知,B为F元素;C、D均能与A按原子个数比为1:1和2:1形成化合物,考虑是H、Na与氧元素形成的化合物,且CB可与EA2反应生成C2A与气态物质EB4,应是HF与二氧化硅反应生成SiF4与水,故C为H元素、A为O元素、D为Na,据此解答.
解答 解:有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大.E的M层电子数是K层电子数的2倍,则M层电子数为4,故E为Si;气态物质EB4中B表现-1价,结合原子序数可知,B为F元素;C、D均能与A按原子个数比为1:1和2:1形成化合物,考虑是H、Na与氧元素形成的化合物,且CB可与EA2反应生成C2A与气态物质EB4,应是HF与二氧化硅反应生成SiF4与水,故C为H元素、A为O元素、D为Na.
(1)由上述分析可知,A、B、C、D、E五种元素的名称为:氧、氟、氢、钠、硅,
故答案为:氧、氟、氢、钠、硅;
(2)E为Si,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)D2A2的化学式为Na2O2,故答案为:Na2O2;
(4)Na单质与铜盐溶液反应的离子方程式:2Na+Cu2++2H2O=Cu(OH)2↓+H2↑+2Na+,
故答案为:2Na+Cu2++2H2O=Cu(OH)2↓+H2↑+2Na+.
点评 本题考查元素化合物推断,推断元素是解题关键,需要学生熟练掌握常见元素化合物的结构与性质,难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
1.45克油脂皂化需6克烧碱,该油脂的相对分子质量是( )
| A. | 300 | B. | 450 | C. | 850 | D. | 900 |
2.一定条件下,可逆反应N2+3H2═2NH3△H<0 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
6. 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
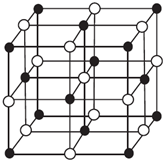
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是TiN>MgO>KCl.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有6个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
3.Na、Cu、C、P、Cl是常见的五种元素.
(1)P原子的最外层电子数为5.
(2)用“>”或“<”填空:
(3)CuCl与O2反应生成CuCl2和一种黑色固体,该反应的化学方程式是4CuCl+O2=2CuCl2+2CuO.
(4)P的最高价氧化物对应的水化物与Na的最高价氧化物对应的水化物反应最多能生成3种盐.
(5)Cl2O为国际公认的高效安全灭菌消毒剂之一,工业上可用Cl2通入Na2CO3溶液制取,同时生成一种食品中的膨松剂,写出该反应的离子方程式2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O.
(1)P原子的最外层电子数为5.
(2)用“>”或“<”填空:
| 离子半径 | 熔点 | 酸性 |
| Cl- >Na+ | NaCl <C(金刚石) | H3PO4 <HClO4 |
(4)P的最高价氧化物对应的水化物与Na的最高价氧化物对应的水化物反应最多能生成3种盐.
(5)Cl2O为国际公认的高效安全灭菌消毒剂之一,工业上可用Cl2通入Na2CO3溶液制取,同时生成一种食品中的膨松剂,写出该反应的离子方程式2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O.
16.下列叙述正确的是(设NA为阿伏加德罗常数的数值)( )
| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
 如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.
如图所示,将1molCH4与1molCl2混合后充入集气瓶内,置于光亮处,让混合气体缓慢地反应一段时间.