题目内容
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质的分离、提纯的基本方法选择与应用
专题:电离平衡与溶液的pH专题,化学实验基本操作
分析:Fe3+易水解生成沉淀,可通过调节溶液pH的方法促进Fe3+的水解,所加物质可与氢离子反应而达到调节pH的目的,注意不能引入新的杂质,以此解答.
解答:
解:加入MgO、Mg(OH)2、MgCO3,与氢离子反应,可起到调节溶液pH的作用,促进铁离子的水解生成氢氧化铁沉淀而除去,且不引入新的杂质,但加入氨水混入氯化铵杂质,且生成氢氧化镁沉淀,
故选A.
故选A.
点评:本题考查物质的分离和提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意根据铁离子易水解的性质用调节溶液pH的方法除杂,注意不能引入新的杂质.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
0.1mol/L氨水中,溶液中随着水量的增加而减少的是( )
A、
| ||
B、
| ||
| C、C(H+)和C(OH-)的乘积 | ||
| D、OH-的物质的量 |
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定依次减弱 |
| B、金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次减小 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl3(g)?PCl3(g).有关数据如下:

下列判断不正确的是( )

下列判断不正确的是( )
| A、10 min内,v(Cl2)=0.04 mol/(L?min) |
| B、当容器中Cl2为1.2 mol时,反应达到平衡 |
| C、升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的转化率变大 |
| D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
 如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.
如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.  现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白: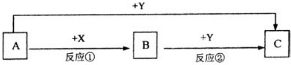 A、B、C三种物质的转化关系如图所示(部分产物已略去)
A、B、C三种物质的转化关系如图所示(部分产物已略去)