题目内容
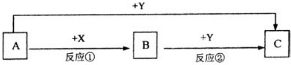 A、B、C三种物质的转化关系如图所示(部分产物已略去)
A、B、C三种物质的转化关系如图所示(部分产物已略去)(1)若A单质是重要的半导体材料,B是光导材料的主要成分,C的焰色反应呈黄色,水溶液呈碱性,是木材防火剂.
①自然界没有单质A存在,工业上用B制备单质A的化学方程式为
②A可与Y的热溶液反应放出最轻的气体和C,其反应的化学方程式为
(2)若A、B、C均为离子化合物,A常用作食品干燥剂;X是一种固体单质且化合物种类繁多,B在常温下与Y快速反应得到白色糊状物C和一种气体,并放出大量热.
①B中阳离子与阴离子的个数比是
②工业中用A与X在电炉中反应制备B并放出一种有毒气体,已知1 mol A与X.反应吸收465.7 kJ的热量,写出该反应的热化学方程式
(3)若A是常见的金属单质,Y是黄绿色气体单质.
①若A与过量的X溶液反应生成B的同时还有某种气体产生,为了减缓反应速率而不影响该气体的总量,可向X溶液中加入适量的
a.CH3COONa(固) b.CuSO4(固) c.KNO3溶液 d.NaCl溶液 e.蒸馏水
②将A与铜的混合金属投入到稀HNO3溶液中,金属全部溶解,气体产物仅有NO,其体积为V1L.继续向该溶液中滴加该HNO3溶液,又产生V2L的NO(气体体积已折算成标准状况).用离子方程式表示第二次产生NO的过程
考点:无机物的推断
专题:推断题
分析:A、B、C三种物质的转化关系如图所示
(1)若A单质是重要的半导体材料,A为硅,B是光导材料的主要成分,B为二氧化硅,C的焰色反应呈黄色,水溶液呈碱性,是木材防火剂,C为硅酸钠,则X为氧气,Y为氢氧化钠,据此答题;
(2)若A、B、C均为离子化合物,A常用作食品干燥剂,则A为氧化钙;X是一种固体单质且化合物种类繁多,则X为碳,B在常温下与Y快速反应得到白色糊状物C和一种气体,并放出大量热,则B为碳化钙,Y为水,C为氢氧化钙,据此答题;
(3)若A是常见的金属单质,Y是黄绿色气体单质,则A为铁,Y为氯气,B为氯化亚铁,X为盐酸,据此答题.
(1)若A单质是重要的半导体材料,A为硅,B是光导材料的主要成分,B为二氧化硅,C的焰色反应呈黄色,水溶液呈碱性,是木材防火剂,C为硅酸钠,则X为氧气,Y为氢氧化钠,据此答题;
(2)若A、B、C均为离子化合物,A常用作食品干燥剂,则A为氧化钙;X是一种固体单质且化合物种类繁多,则X为碳,B在常温下与Y快速反应得到白色糊状物C和一种气体,并放出大量热,则B为碳化钙,Y为水,C为氢氧化钙,据此答题;
(3)若A是常见的金属单质,Y是黄绿色气体单质,则A为铁,Y为氯气,B为氯化亚铁,X为盐酸,据此答题.
解答:
解:(1)若A单质是重要的半导体材料,A为硅,B是光导材料的主要成分,B为二氧化硅,C的焰色反应呈黄色,水溶液呈碱性,是木材防火剂,C为硅酸钠,则X为氧气,Y为氢氧化钠,
①工业上用二氧化硅制备单质硅的化学方程式为SiO2+2C
Si+2CO,
故答案为:SiO2+2C
Si+2CO;
②A可与Y的热溶液反应放出最轻的气体和C,其反应的化学方程式为Si+2NaOH+H2O═Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O═Na2SiO3+2H2↑;
(2)若A、B、C均为离子化合物,A常用作食品干燥剂,则A为氧化钙;X是一种固体单质且化合物种类繁多,则X为碳,B在常温下与Y快速反应得到白色糊状物C和一种气体,并放出大量热,则B为碳化钙,Y为水,C为氢氧化钙,
①CaC2中阳离子与阴离子的个数比是1:1,
故答案为:1:1;
②工业中用氧化钙与碳在电炉中反应制备碳化钙并放出一种有毒气体为一氧化碳,已知1 mol A与X,反应吸收465.7 kJ的热量,写出该反应的热化学方程式为3C(s)+CaO(s)=CaC2(s)+CO(g)△H=+465.7 kJ/mol,
故答案为:3C(s)+CaO(s)=CaC2(s)+CO(g)△H=+465.7 kJ/mol;
(3)若A是常见的金属单质,Y是黄绿色气体单质,则A为铁,Y为氯气,B为氯化亚铁,X为盐酸,
①铁与盐酸反应,为了减缓反应速率而不影响该气体的总量,就要使溶液中氢子浓度降低,但产生氢气的氢离子总物质的量不变,所以可向盐酸溶液中加入适量的CH3COONa(固)或 蒸馏水或NaCl溶液(相当于水的作用),而不能加KNO3溶液,因为硝酸根离子有氧化性,加入之后不能产生氢气,也不能加CuSO4(固),因为会构成原电池,加快反应速率,所以选ade,
故答案为:ade;
②将A与铜的混合金属投入到稀HNO3溶液中,金属全部溶解,气体产物仅有NO,其体积为V1L.继续向该溶液中滴加该HNO3溶液,又产生V2L的NO,第二次之所以NO产生,是因为第一次所得的溶液中有Fe2+,与硝酸发生氧化还原反应,离子方程式为3Fe2++4H++NO3-=NO+3Fe3++2H2O,根据氧化还原反应电子得失守恒可知,两次共产生V1L+V2L的NO,溶液中产生的阳离子所带正电荷的物质的量为
×3mol,所以反应最后溶液中硝酸根离子的物质的量为
×3mol,所以根据氮元素守恒,整个过程中所需HNO3的物质的量为
×3mol+
mol=
mol,
故答案为:3Fe2++4H++NO3-=NO+3Fe3++2H2O;
.
①工业上用二氧化硅制备单质硅的化学方程式为SiO2+2C
| ||
故答案为:SiO2+2C
| ||
②A可与Y的热溶液反应放出最轻的气体和C,其反应的化学方程式为Si+2NaOH+H2O═Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O═Na2SiO3+2H2↑;
(2)若A、B、C均为离子化合物,A常用作食品干燥剂,则A为氧化钙;X是一种固体单质且化合物种类繁多,则X为碳,B在常温下与Y快速反应得到白色糊状物C和一种气体,并放出大量热,则B为碳化钙,Y为水,C为氢氧化钙,
①CaC2中阳离子与阴离子的个数比是1:1,
故答案为:1:1;
②工业中用氧化钙与碳在电炉中反应制备碳化钙并放出一种有毒气体为一氧化碳,已知1 mol A与X,反应吸收465.7 kJ的热量,写出该反应的热化学方程式为3C(s)+CaO(s)=CaC2(s)+CO(g)△H=+465.7 kJ/mol,
故答案为:3C(s)+CaO(s)=CaC2(s)+CO(g)△H=+465.7 kJ/mol;
(3)若A是常见的金属单质,Y是黄绿色气体单质,则A为铁,Y为氯气,B为氯化亚铁,X为盐酸,
①铁与盐酸反应,为了减缓反应速率而不影响该气体的总量,就要使溶液中氢子浓度降低,但产生氢气的氢离子总物质的量不变,所以可向盐酸溶液中加入适量的CH3COONa(固)或 蒸馏水或NaCl溶液(相当于水的作用),而不能加KNO3溶液,因为硝酸根离子有氧化性,加入之后不能产生氢气,也不能加CuSO4(固),因为会构成原电池,加快反应速率,所以选ade,
故答案为:ade;
②将A与铜的混合金属投入到稀HNO3溶液中,金属全部溶解,气体产物仅有NO,其体积为V1L.继续向该溶液中滴加该HNO3溶液,又产生V2L的NO,第二次之所以NO产生,是因为第一次所得的溶液中有Fe2+,与硝酸发生氧化还原反应,离子方程式为3Fe2++4H++NO3-=NO+3Fe3++2H2O,根据氧化还原反应电子得失守恒可知,两次共产生V1L+V2L的NO,溶液中产生的阳离子所带正电荷的物质的量为
| V1+V2 |
| 22.4 |
| V1+V2 |
| 22.4 |
| V1+V2 |
| 22.4 |
| V1+V2 |
| 22.4 |
| V1+V2 |
| 5.6 |
故答案为:3Fe2++4H++NO3-=NO+3Fe3++2H2O;
| V1+V2 |
| 5.6 |
点评:本题主要考查了常见物质之间的转化关系,中等难度,物质的种类的判断是解题的关键,答题时注意在计算中充分运用守恒的思想解决问题.

练习册系列答案
相关题目
溶度积常数(Ksp)是表示判断物质性质的重要常数,下列说法中,正确的是( )
| A、饱和石灰水中加入一定量的生石灰,温度明显升高,Ksp减少 |
| B、向CaCl2 溶液中通入CO2气体不能产生沉淀,是因为c(Ca2+ )?c(CO32-)>Ksp(CaCO3) |
| C、向BaCl2 溶液中加入等量的同浓度的 Na2CO3 和Na2SO4 溶液先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D、Ksp小的物质的溶解能力一定比Ksp大的物质小 |
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
将2.0molPCl3和2.0molCl2充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g) 达到平衡时,PCl5为1.0mol;如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是( )
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |


 ,回答下列问题:
,回答下列问题: