题目内容
0.1mol/L氨水中,溶液中随着水量的增加而减少的是( )
A、
| ||
B、
| ||
| C、C(H+)和C(OH-)的乘积 | ||
| D、OH-的物质的量 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:NH3?H2O?NH4++OH-,用水稀释促进电离,平衡正向移动,n(NH3?H2O)减少,n(NH4+)增加,加水稀释促进一水合氨电离,溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,温度不变,水的离子积常数不变,则c(H+)增大.
解答:
解:A.用水稀释促进电离,平衡正向移动,n(NH3?H2O)减少,n(OH-)增大,
=
增大,故A错误;
B.用水稀释促进电离,平衡正向移动,n(NH3?H2O)减少,n(OH-)增大,则
减小,故B正确;
C.温度不变C(H+)和C(OH-)的乘积为Kw,是常数,所以不变,故C错误;
D.用水稀释促进电离,平衡正向移动,n(OH-)增大,故D错误.
故选B.
| c(OH-) |
| c(NH3?H2O) |
| n(OH-) |
| n(NH3?H2O) |
B.用水稀释促进电离,平衡正向移动,n(NH3?H2O)减少,n(OH-)增大,则
| c(NH3?H2O) |
| c(OH-) |
C.温度不变C(H+)和C(OH-)的乘积为Kw,是常数,所以不变,故C错误;
D.用水稀释促进电离,平衡正向移动,n(OH-)增大,故D错误.
故选B.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,根据溶液中离子浓度变化来分析解答,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
下列变化过程一定需要加入还原剂才能实现的是( )
| A、KClO3→KCl |
| B、CO2→C |
| C、Fe→Fe2+ |
| D、NaCl→HCl |
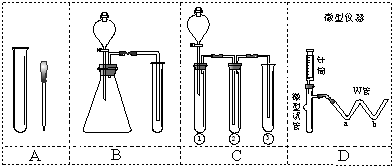
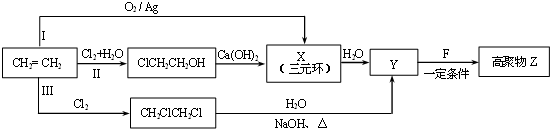
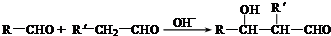 (R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.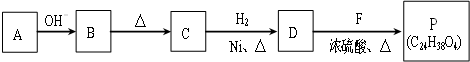
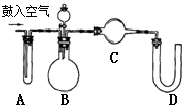 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.