题目内容
PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl3(g)?PCl3(g).有关数据如下:

下列判断不正确的是( )

下列判断不正确的是( )
| A、10 min内,v(Cl2)=0.04 mol/(L?min) |
| B、当容器中Cl2为1.2 mol时,反应达到平衡 |
| C、升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的转化率变大 |
| D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
考点:化学平衡的计算
专题:
分析:A、根据v=
求得PCl5的速率,利用速率之比等于计量数之比求得Cl2的速率;
B、平衡时生成PCl5的物质的量为0.4×2mol=0.8mol,根据化学方程式可知,此时消耗Cl2的物质的量为0.8mol,容器中剩余Cl2的物质的量为1mol/L×2-0.8mol=1.2mol,据此判断;
C、若升高温度,反应的平衡常数减小,平衡逆向移动,则PCl3的转化率变小;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,据此判断;
| △c |
| t |
B、平衡时生成PCl5的物质的量为0.4×2mol=0.8mol,根据化学方程式可知,此时消耗Cl2的物质的量为0.8mol,容器中剩余Cl2的物质的量为1mol/L×2-0.8mol=1.2mol,据此判断;
C、若升高温度,反应的平衡常数减小,平衡逆向移动,则PCl3的转化率变小;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,据此判断;
解答:
解:A、根据v=
求得PCl5的速率为
mol?L-1?min-1=0.04mol?L-1?min-1,利用速率之比等于计量数之比求得Cl2的速率为0.04mol?L-1?min-1,故A正确;
B、平衡时生成PCl5的物质的量为0.4×2mol=0.8mol,根据化学方程式可知,此时消耗Cl2的物质的量为0.8mol,容器中剩余Cl2的物质的量为1mol/L×2-0.8mol=1.2mol,故B正确;
C、若升高温度,反应的平衡常数减小,平衡逆向移动,则PCl3的转化率变小,故C错误;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,故D正确;
故选C.
| △c |
| t |
| 0.4 |
| 10 |
B、平衡时生成PCl5的物质的量为0.4×2mol=0.8mol,根据化学方程式可知,此时消耗Cl2的物质的量为0.8mol,容器中剩余Cl2的物质的量为1mol/L×2-0.8mol=1.2mol,故B正确;
C、若升高温度,反应的平衡常数减小,平衡逆向移动,则PCl3的转化率变小,故C错误;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,故D正确;
故选C.
点评:本题主要考查了影响平衡常数的因素、反应速率的计算、平衡移动的影响因素,中等难度,D选项解题时要注意等效平衡的思想的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )
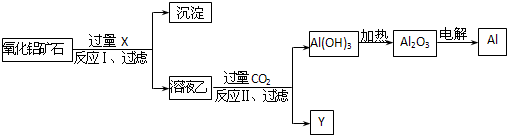

| A、试剂X可以为氨水,沉淀中含有铁的化合物 |
| B、CO2可以用H2SO4溶液或稀盐酸代替 |
| C、反应II中的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、工业上还可采用Fe还原Al2O3的方法制Al,成本更低 |
通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
| A、硝酸钠 氢氧化钠 |
| B、氧化铜 二氧化锰 |
| C、氯化钾 碳酸钙 |
| D、硫酸铜 氢氧化钠 |
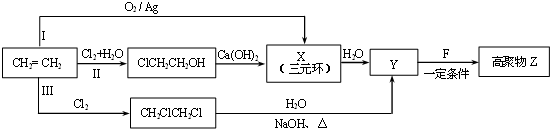
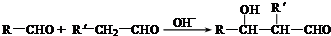 (R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.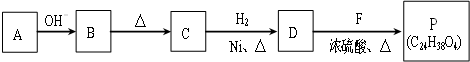
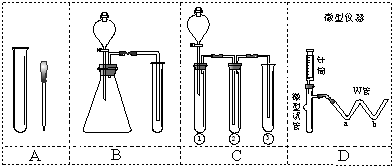
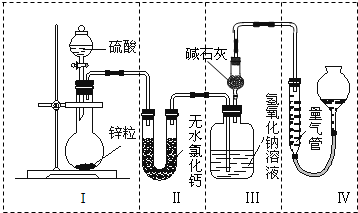 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).