题目内容
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
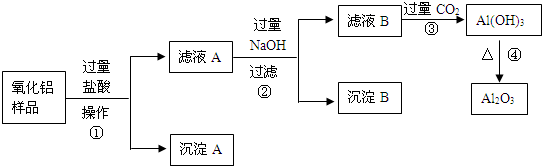
(1)沉淀A的成分是 (填化学式),沉淀B的成分是 (填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为 、 ;
(3)在操作Ⅰ的名称是 ,其中玻璃棒的作用是 .

(1)沉淀A的成分是
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为
(3)在操作Ⅰ的名称是
考点:物质分离和提纯的方法和基本操作综合应用,物质分离、提纯的实验方案设计
专题:实验设计题
分析:由分离流程可知,氧化铝样品中含有氧化铁和二氧化硅杂质,加入过量盐酸,氧化铝与过量盐酸反应生成氯化铝,氧化铁和盐酸反应生成氯化铁,二氧化硅不与盐酸反应,则操作I为过滤,得到沉淀A为SiO2,滤液A中含氯化铝、氯化铁、盐酸,再加入过量NaOH,氯化铝与碱反应生成偏铝酸钠和氯化钠,氯化铁与碱反应生成氢氧化铁沉淀和氯化钠,盐酸与碱反应生成氯化钠,则操作为过滤,得到沉淀B为Fe(OH)3,滤液中有NaAlO2、NaCl、NaOH,再通入过量的二氧化碳,与NaAlO2反应生成Al(OH)3,分解生成氧化铝,以此来解答.
解答:
解:由分离流程可知,氧化铝样品中含有氧化铁和二氧化硅杂质,加入过量盐酸,氧化铝与过量盐酸反应生成氯化铝,氧化铁和盐酸反应生成氯化铁,二氧化硅不与盐酸反应,则操作I为过滤,得到沉淀A为SiO2,滤液A中含氯化铝、氯化铁、盐酸,再加入过量NaOH,氯化铝与碱反应生成偏铝酸钠和氯化钠,氯化铁与碱反应生成氢氧化铁沉淀和氯化钠,盐酸与碱反应生成氯化钠,则操作为过滤,得到沉淀B为Fe(OH)3,滤液中有NaAlO2、NaCl、NaOH,再通入过量的二氧化碳,与NaAlO2反应生成Al(OH)3,分解生成氧化铝,
(1)由上述分析可知,沉淀A为SiO2,沉淀B为Fe(OH)3,故答案为:SiO2;Fe(OH)3;
(2)滤液A中含氯化铝、氯化铁、盐酸,则滤液A中若加入过量的铁粉,可能发生的所有离子方程式为Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3 Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3 Fe2+;
(3)由上述分析可知,操作I为过滤,玻璃棒的作用为引流,故答案为:过滤;引流.
(1)由上述分析可知,沉淀A为SiO2,沉淀B为Fe(OH)3,故答案为:SiO2;Fe(OH)3;
(2)滤液A中含氯化铝、氯化铁、盐酸,则滤液A中若加入过量的铁粉,可能发生的所有离子方程式为Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3 Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3 Fe2+;
(3)由上述分析可知,操作I为过滤,玻璃棒的作用为引流,故答案为:过滤;引流.
点评:本题考查混合物分离提纯的综合应用,为高频考点,把握分离流程中发生的反应及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )
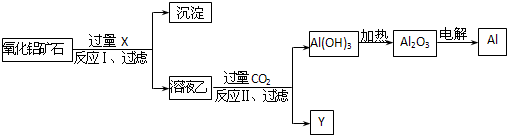

| A、试剂X可以为氨水,沉淀中含有铁的化合物 |
| B、CO2可以用H2SO4溶液或稀盐酸代替 |
| C、反应II中的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、工业上还可采用Fe还原Al2O3的方法制Al,成本更低 |
将2.0molPCl3和2.0molCl2充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g) 达到平衡时,PCl5为1.0mol;如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是( )
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
| A、硝酸钠 氢氧化钠 |
| B、氧化铜 二氧化锰 |
| C、氯化钾 碳酸钙 |
| D、硫酸铜 氢氧化钠 |
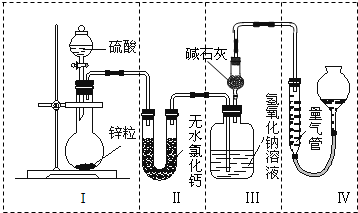 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃). 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.