题目内容
 现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是:
(2)如果用酚酞做指示剂,试判断到达滴定终点的实验现象是
(3)如图1是酸式滴定管中液面在滴定前后的读数,c(NaOH)=
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,则测定的NaOH溶液的物质的量浓度
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:(1)滴定管使用前应润洗;
(2)用酚酞做指示剂,滴定终点时溶液颜色由无色变为浅红色,且半分钟内不褪色;
(2)根据关系式NaOH~HCl来计算;
(4)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断浓度的误差.
(2)用酚酞做指示剂,滴定终点时溶液颜色由无色变为浅红色,且半分钟内不褪色;
(2)根据关系式NaOH~HCl来计算;
(4)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
解答:
解:(1)酸式滴定管用蒸馏水洗净后,用标准盐酸润洗2-3次,故答案为:标准盐酸润洗2-3次;
(2)根据滴定终点,溶液由无色恰好变为红色,且半分钟内不褪色,停止滴定,故答案为:溶液由浅红色褪成无色,且半分钟内不变色;
(3)滴定终止时消耗盐酸溶液(V2-V1)mL,
NaOH~HCl
1 1
c(NaOH)×VmL a mol?L-1×(V2-V1)mL
c(NaOH )=
mol/L,
故答案为:
;
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
可知,c(标准)偏大,则测定的NaOH溶液的物质的量浓度偏高,故答案为:偏高.
(2)根据滴定终点,溶液由无色恰好变为红色,且半分钟内不褪色,停止滴定,故答案为:溶液由浅红色褪成无色,且半分钟内不变色;
(3)滴定终止时消耗盐酸溶液(V2-V1)mL,
NaOH~HCl
1 1
c(NaOH)×VmL a mol?L-1×(V2-V1)mL
c(NaOH )=
| a(V2-V1) |
| V |
故答案为:
| a(V2-V1) |
| V |
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
点评:本题主要考查了中和滴定操作、误差分析以及计算,难度不大,根据课本知识即可完成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组物质按酸、碱、盐分类顺次排列,其中正确的是( )
| A、硫酸 烧碱 小苏打 |
| B、硝酸 纯碱 胆矾 |
| C、醋酸 酒精 石灰石 |
| D、盐酸 熟石灰 苛性钠 |
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
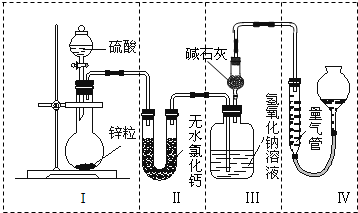 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).