题目内容
 如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.
如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表. | 序号 | 实验操作 | 对应编号 |
| ① | 向澄清石灰水中通入CO2至过量 | |
| ② | 向AlCl3溶液中逐滴加入氨水至过量 | |
| ③ | 向含有盐酸的MgCl2、AlCl3溶液中通入NaOH溶液至过量 | |
| ④ | 向NaAlO2溶液中逐滴加入盐酸至过量 |
①下列制取钛的方法中,你认为
A.钠与TiClx的水溶液反应
B.钠与TiClx在气相中反应
C.用熔融的镁在稀有气体中还原TiClx
②如用钠与TiClx反应制取钛,其反应的化学方程式为
③如果钠与TiClx反应时,每转移2mol电子就生成24g钛,则x为
考点:离子方程式的有关计算,金属冶炼的一般原理
专题:
分析:(1)A表示加入某溶液,沉淀质量先增大到最大,再加入该溶液沉淀质量减少到0;
B.表示加入某溶液,沉淀达最大量后,加入某溶液,沉淀不再变化;
C.表示先后加入等体积的某溶液,先沉淀最大量,后沉淀全部溶解;
D.表示加入某溶液,一段时间后产生沉淀直到沉淀最大量,后沉淀部分溶解;
(2)①依据给出数据可知钠、镁的沸点都低于钛,且活泼性强于钛;钠性质活泼与盐溶液反应时,先与溶液中的水反应;
②钠与TiClx反应生成氯化钠和钛;
③依据TiClx可知钛的化合价为+x,依据Tix++xe-=Ti计算X.
B.表示加入某溶液,沉淀达最大量后,加入某溶液,沉淀不再变化;
C.表示先后加入等体积的某溶液,先沉淀最大量,后沉淀全部溶解;
D.表示加入某溶液,一段时间后产生沉淀直到沉淀最大量,后沉淀部分溶解;
(2)①依据给出数据可知钠、镁的沸点都低于钛,且活泼性强于钛;钠性质活泼与盐溶液反应时,先与溶液中的水反应;
②钠与TiClx反应生成氯化钠和钛;
③依据TiClx可知钛的化合价为+x,依据Tix++xe-=Ti计算X.
解答:
解:①澄清石灰水中通入过量二氧化碳,先发生氢氧化钙与二氧化碳的反应生成碳酸钙沉淀,再发生碳酸钙与水、二氧化碳反应,沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系,符合图象C;
②AlCl3溶液和氨水反应生成氢氧化铝沉淀,沉淀达到最大后不能溶解在过量氨水中,符合图象B;
③向含有盐酸的MgCl2、AlCl3溶液中通入NaOH溶液至过量,AlCl3、MgCl2的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解,符合图象D;
④向NaAlO2溶液中逐滴加入盐酸至过量,偏铝酸钠先与盐酸反应生成氢氧化铝沉淀,然后氢氧化铝再与盐酸发生酸碱中和生成氯化铝,沉淀完全溶解,符合图象A;
故答案为:C、B、D、A;
(2)①依据给出数据可知钠、镁的沸点都低于钛,且活泼性强于钛都能够从熔融状态的氯化钛置换钛;钠性质活泼,投入到TiClx的水溶液,先与水发生反应;
故选:A;
②与TiClx反应生成氯化钠和钛,化学方程式为:TiClx+xNa
Ti+xNaCl;
故答案为:TiClx+xNa
Ti+xNaCl;
③钠与TiClx反应时,每转移2mol电子就生成24g钛,依据
Tix++xe-=Ti
x 48g
2 24g 解得x=4;
故答案为:4.
②AlCl3溶液和氨水反应生成氢氧化铝沉淀,沉淀达到最大后不能溶解在过量氨水中,符合图象B;
③向含有盐酸的MgCl2、AlCl3溶液中通入NaOH溶液至过量,AlCl3、MgCl2的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解,符合图象D;
④向NaAlO2溶液中逐滴加入盐酸至过量,偏铝酸钠先与盐酸反应生成氢氧化铝沉淀,然后氢氧化铝再与盐酸发生酸碱中和生成氯化铝,沉淀完全溶解,符合图象A;
故答案为:C、B、D、A;
(2)①依据给出数据可知钠、镁的沸点都低于钛,且活泼性强于钛都能够从熔融状态的氯化钛置换钛;钠性质活泼,投入到TiClx的水溶液,先与水发生反应;
故选:A;
②与TiClx反应生成氯化钠和钛,化学方程式为:TiClx+xNa
| ||
故答案为:TiClx+xNa
| ||
③钠与TiClx反应时,每转移2mol电子就生成24g钛,依据
Tix++xe-=Ti
x 48g
2 24g 解得x=4;
故答案为:4.
点评:本题考查本题考查化学反应与图象的关系、金属的制备反应,明确图象中各段发生的化学反应是解题关键,注意钠与盐溶液反应的实质,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、1 mol CO2 的质量为44g/mol |
| B、摩尔是表示原子、分子、离子个数的单位 |
| C、64g氧气中含有2mol氧 |
| D、NA个CO2的质量(以g为单位)与CO2的摩尔质量在数值上相同 |
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )
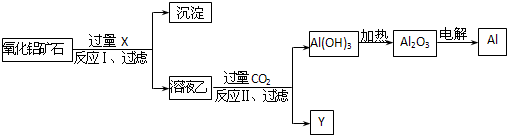

| A、试剂X可以为氨水,沉淀中含有铁的化合物 |
| B、CO2可以用H2SO4溶液或稀盐酸代替 |
| C、反应II中的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、工业上还可采用Fe还原Al2O3的方法制Al,成本更低 |
 U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH
U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH
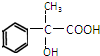 ,回答下列问题:
,回答下列问题: