题目内容
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定依次减弱 |
| B、金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次减小 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
考点:化学键
专题:
分析:A.元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定;
B.原子晶体,键能越大,硬度大、熔点高;
C.离子晶体中影响熔沸点的因素是离子键;
D.组成和结构相似的分子晶体,相对分子质量越大,沸点越大.
B.原子晶体,键能越大,硬度大、熔点高;
C.离子晶体中影响熔沸点的因素是离子键;
D.组成和结构相似的分子晶体,相对分子质量越大,沸点越大.
解答:
解:A.非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与键能有关,故A不选;
B.金刚石中键能大于硅中的键能,则金刚石的硬度大,熔点高,与键能有关,故B不选;
C.NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,与键能有关,故C不选;
D.F2、Cl2、Br2、I2的相对分子质量在增大,则熔、沸点在增大,与键能无关,故D选.
故选D.
B.金刚石中键能大于硅中的键能,则金刚石的硬度大,熔点高,与键能有关,故B不选;
C.NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,与键能有关,故C不选;
D.F2、Cl2、Br2、I2的相对分子质量在增大,则熔、沸点在增大,与键能无关,故D选.
故选D.
点评:本题考查了物质性质和化学键的关系,注意化学键和分子间作用力的区别,题目难度不大.

练习册系列答案
相关题目
已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )
| A、NH3?H2O |
| B、MgO |
| C、Mg(OH)2 |
| D、MgCO3 |
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )
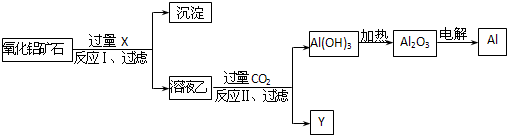

| A、试剂X可以为氨水,沉淀中含有铁的化合物 |
| B、CO2可以用H2SO4溶液或稀盐酸代替 |
| C、反应II中的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、工业上还可采用Fe还原Al2O3的方法制Al,成本更低 |
 U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH
U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH