题目内容
15.能够证明甲烷分子的空间结构为正四面体的事实是( )| A. | 甲烷的4个碳氢键的键能相等 | B. | 甲烷的4个碳氢键的键长相等 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷的二氯代物只有1种 |
分析 A.若是平面正方形结构,甲烷的4个碳氢键的键长、键能也相等;
B.甲烷如果是平面结构,甲烷的4个碳氢键的键长也相等;
C.甲烷若是平面结构,甲烷中的四个氢原子位置也相同;
D.如果甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合.
解答 解:A.由于甲烷为平面正方形结构时,甲烷的4个碳氢键的键能也相等,所以无法判断甲烷为正四面体结构,故A错误;
B.甲烷无论是正四面体结构,还是正方形,甲烷的4个碳氢键的键长都相等,无法判断甲烷的结构,故B错误;
C.甲烷无论是正四面体结构,还是正方形,其一氯代物只有1种,不能说明分子结构,故C错误;
D.若为平面正方形结构,二氯甲烷有两种同分异构体,而正四面体的二氯甲烷不存在同分异构体,故D正确;
故选D.
点评 本题考查甲烷的分子结构,题目难度不大,注意掌握常见有机物的结构与性质,明确二氯甲烷没有同分异构体说明甲烷是正四面体结构.

练习册系列答案
相关题目
5.下列物质性质与应用对应关系正确的是( )
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
6.抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部不适.下列物质不能作抗酸药的是( )
| A. | 碳酸氢钠 | B. | 氢氧化铝 | C. | 碳酸镁 | D. | 硫酸钡 |
3.下列说法不正确的是( )
| A. | H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强 | |
| B. | I-的还原性比Br-强,由此可推断溴的非金属性比碘强 | |
| C. | H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强 | |
| D. | 已知反应:2NH3+3Cl2═N2+6HCl,由此可推断非金属性氯强于氮 |
20.现有部分短周期元素的性质或原子结构如下表:
(1)元素X在元素周期表中的位置为第二周期第ⅣA族,它的一种核素可测定文物年代,这种核素的符号是146C.
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
4.依据下表短周期元素原子半径及主要化合价,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 还原性 H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | M与T形成的化合物能与NaOH溶液反应 | |
| D. | L2+与R2-的核外电子数相等 |
5.下列关于如图所示装置的叙述不正确的是( )
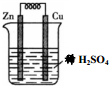

| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
 .
.