题目内容
5.下列关于如图所示装置的叙述不正确的是( )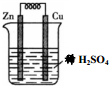
| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
分析 锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子,铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极,以此解答该题.
解答 解:A、锌比铜活泼,应为原电池的负极,铜是正极,故A正确;
B、锌失电子变成锌离子,所以质量减小,故B正确;
C、电子由负极锌流出,沿导线流入铜,故C错误;
D、正极是氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,故D正确;
故选C.
点评 本题考查学生原电池的工作原理,为高频考点,侧重于双基的考查,注意把握正负极的判断及电子流向从负极沿导线流向正极,题目难度不大.

练习册系列答案
相关题目
15.能够证明甲烷分子的空间结构为正四面体的事实是( )
| A. | 甲烷的4个碳氢键的键能相等 | B. | 甲烷的4个碳氢键的键长相等 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷的二氯代物只有1种 |
13.某气态烃1mol能与2molHCl加成,所得的加成产物每摩尔又能与8molCl2反应,最后得到一种只含C、Cl两种元素的化合物,则气态烃为( )
| A. | 丙烯 | B. | 1-丁炔 | ||
| C. | 丁烯 | D. | 2-甲基-1,3-丁二烯 |
20.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )

| A. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| B. | Z位于元素周期表中第二周期,第ⅥA族 | |
| C. | X的气态氢化物的稳定性比Z的弱 | |
| D. | M的原子半径比Y的原子半径大 |
10.目前世界上60%的镁是从海水中提取的.主要步骤如下: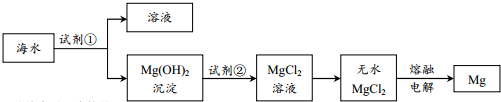
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳 | |
| B. | 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤 | |
| C. | 加入试剂②反应的离子方程式为:OH-+H+=H2O | |
| D. | 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子 |
17.下列说法正确的是( )
| A. | 蔗糖在硫酸催化下水解,只生成葡萄糖 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 1L1mol•L-1AlCl3溶液中含Al3+数目为6.02×1023 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
14.为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
(1)设计实验2和实验3的目的是研究H2O2的浓度对化学反应速率的影响.
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液 ③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸 ⑤0.1mol•L-1KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示.

(1)反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液 ③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸 ⑤0.1mol•L-1KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示.

(1)反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.
15. C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
 C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60分子内共用电子对数目相同 | |
| C. | 由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
 被氧化为
被氧化为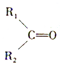 和
和 (R1、R2、R3、R4表示烃基或氢原子).由此推断分子式为C5H10的烯烃所有可能的氧化产物有( )
(R1、R2、R3、R4表示烃基或氢原子).由此推断分子式为C5H10的烯烃所有可能的氧化产物有( )