题目内容
5.下列物质性质与应用对应关系正确的是( )| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
分析 A.二氧化硅具有对光良好的全反射作用,可用于制光导纤维;
B.浓硫酸具有吸水性,可作干燥剂;
C.漂白粉在空气中与水、二氧化碳反应生成HClO,HClO可漂白纸张;
D.熔点高的物质可作耐火材料.
解答 解:A.二氧化硅具有对光良好的全反射作用,可用于制光导纤维,与二氧化硅能与氢氟酸反应无因果关系,故A错误;
B.浓硫酸具有吸水性,可作干燥剂,干燥氯气与脱水性无关,故B错误;
C.漂白粉在空气中与水、二氧化碳反应生成HClO,HClO可漂白纸张,HClO不稳定易光照分解,故C错误;
D.熔点高的物质可作耐火材料,则氧化铝熔点很高,可用于制耐火材料,故D正确;
故选D.
点评 本题考查物质的性质、应用,为高频考点,把握物质的性质、发生的反应、化学与生活等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)═CH3OH(g);△H<0.2min时只改变一个条件,反应情况如下表:下列说法不正确的是( )
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
13. 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
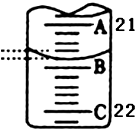
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是BCD
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=$\frac{\frac{5}{2}×c×\frac{(25.35+25.30)}{2}×10{\;}^{-3}}{V×1{0}^{-3}}$mol/L.
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=$\frac{\frac{5}{2}×c×\frac{(25.35+25.30)}{2}×10{\;}^{-3}}{V×1{0}^{-3}}$mol/L.
20.下列说法正确的是( )
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
10.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性的强弱顺序为XH3<H2Y<HZ,下列说法中正确的是( )
| A. | 原子序数:X>Y>Z | B. | 非金属性:X<Y<Z | ||
| C. | 原子半径:X<Y<Z | D. | 原子得电子能力:X>Y>Z |
17.下列各组物质中,每种物质都既含离子键又含共价键的是( )
| A. | Na2O2、CaCl2 | B. | CO2、CH4 | C. | NH4Cl、NaOH | D. | NaF、HNO3 |
14. 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态碳原子核外有6种空间运动状态的电子,其价电子排布图为 .
.
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形,其碳原子杂化轨道类型为sp2杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解
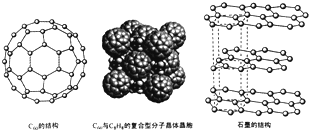
(4)碳的一种同素异形体--C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体: )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
(5)碳的另一种同素异形体--石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞.则石墨晶胞含碳原子个数为4个.已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为$\frac{\sqrt{3}}{16}$ρNAr2cm.
 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:(1)基态碳原子核外有6种空间运动状态的电子,其价电子排布图为
 .
.(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形,其碳原子杂化轨道类型为sp2杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)碳的一种同素异形体--C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60(5)碳的另一种同素异形体--石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞.则石墨晶胞含碳原子个数为4个.已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为$\frac{\sqrt{3}}{16}$ρNAr2cm.
15.能够证明甲烷分子的空间结构为正四面体的事实是( )
| A. | 甲烷的4个碳氢键的键能相等 | B. | 甲烷的4个碳氢键的键长相等 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷的二氯代物只有1种 |
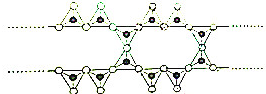 在结构中,
在结构中,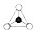 表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.
表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.