题目内容
1.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中.电解NaB(OH)4溶液可制备H3BO3,其工作原理如图.下列叙述错误的是( )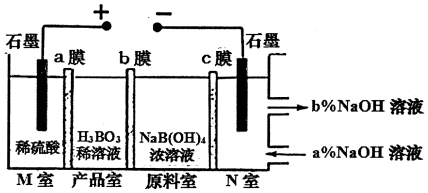
| A. | M室发生的电极反应式:2H2O-4e-═O2↑+4H+ | |
| B. | N室:a%<b% | |
| C. | 产品室发生的反应是:B(OH)4-+H+?H3BO3+H2O | |
| D. | 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体 |
分析 A.M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+;
B.N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大;
C.原料室中的B(OH)4-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,B(OH)4-、H+发生反应生成H3BO3;
D.理论上每生成1mol产品,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成1molH+、N室生成0.5molH2.
解答 解:A.M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-═O2↑+4H+,故A正确;
B.N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室:a%<b%,故B正确;
C.原料室中的B(OH)4-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,B(OH)4-、H+发生反应生成H3BO3,反应方程式为B(OH)4-+H+?H3BO3+H2O,故C正确;
D.理论上每生成1mol产品,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成1molH+、N室生成0.5molH2,阴极生成的气体体积在标况下是11.2L,故D错误;
故选D.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,注意膜类型的判断方法,题目难度不大.

练习册系列答案
相关题目
12.下列化合物中,只含有离子键的是( )
| A. | CaCl2 | B. | NH3 | C. | H2O | D. | KOH |
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| B. | 28g乙烯和环丙烷(C3H6)组成的混合气体,完全燃烧时,转移的电子数为12NA | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中,所含NH4+数小于0.2NA | |
| D. | 标准状况下,2.24 L18O2中含有2NA个中子 |
10.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.2 mol•L-1NH4CI溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA |
11.在恒容密闭容器中发生反应H2(g)+I2(g)?2HI(g)+9.4kJ,下列说法能说明该反应一定达到平衡的是( )
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |

 .
. .
. 碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
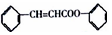 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
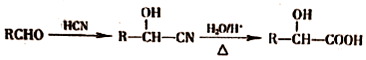
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (任写一种).
(任写一种).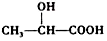 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物).
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物).