题目内容
16.黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义.(1)工业上煅烧黄铁矿可制取SO2.已知下列热化学方程式
4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=akJ/mol
S(s)+O2(g)═SO2(g)△H=bkJ/mol
Fe(s)+2S(s)═FeS2(s)△H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s)△H=a+4c-8bkJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示.
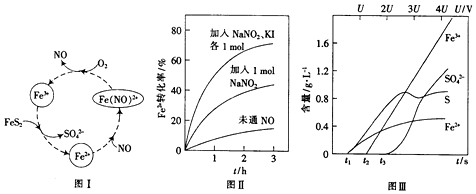
(1)写出图1中Fe3+与FeS2反应的离子方程式:14Fe3++FeS2+8H2O=15Fe2++2SO4-+16H+.
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能.
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化.
①加入NaNO2发生反应:2H++3NO2-═NO3-+2NO+H2O.若1mol NaNO2完全反应则转移电子的数目为$\frac{2}{3}$mol.
②加入NaNO2、KI发生反应:4H++2NO2-+2I-═2NO+I2+2H2O.解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:生成的催化剂NO更多,加快了反应速率.
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图 III所示.
①写出t1至t2间FeS2所发生的电极反应式:FeS2-2e-=Fe2++2S.
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为Fe3+、SO42-.
分析 (1)①4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=akJ/mol
②S(s)+O2(g)═SO2(g)△H=bkJ/mol
③Fe(s)+2S(s)═FeS2(s)△H=ckJ/mol,①+4×③-8×②得,4Fe(s)+3O2(g)=2Fe2O3(s)△H=(a+4c-8b)kJ/mol,据此进行分析;
(1)Fe3+与FeS2反应生成Fe2+与SO4-和H+;
(2)据稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能来分析;
(3)①据2H++3NO2-═NO3-+2NO+H2O此方程式中NaNO2的量,求转移电子数目;
②生成的催化剂NO更多,加快了反应速率;
(4)①FeS2失电子发生氧化反应据此书写电极方程式;
②由图象得,在3U~4U之间溶液中主要粒子有Fe3+、SO42-.
解答 解:(1)①4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=akJ/mol
②S(s)+O2(g)═SO2(g)△H=bkJ/mol
③Fe(s)+2S(s)═FeS2(s)△H=ckJ/mol,①+4×③-8×②得,4Fe(s)+3O2(g)=2Fe2O3(s)△H=(a+4c-8b)kJ/mol,
故答案为:a+4c-8b;
(1)Fe3+与FeS2反应生成Fe2+与SO4-和H+,故离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO4-+16H+,
故答案为:14Fe3++FeS2+8H2O=15Fe2++2SO4-+16H+;
(2)硝酸比使用稀硝酸反应速率慢,其原因是稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能,
故答案为:稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能;
(3)①2H++3NO2-═NO3-+2NO+H2O~2mole-
3 2
1 $\frac{2}{3}$,
故答案为:$\frac{2}{3}$;
②图II中该条件下能进一步提高单位时间内Fe2+转化率的原因是生成的催化剂NO更多,加快了反应速率,
故答案为:生成的催化剂NO更多,加快了反应速率;
(4)①FeS2失电子发生氧化反应,故电极方程式FeS2-2e-=Fe2++2S,
故答案为:FeS2-2e-=Fe2++2S;
②据图象分析,介于3U~4U之间,FeS2放电所得主要粒子为Fe3+、SO42-,
故答案为:Fe3+、SO42-.
点评 本题主要考查反应热的计算,电极方程式的书写,离子方程式的书写,据方程式求算电子转移的数目等,本题难度中等.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | +46 kJ/mol | B. | +92kJ/mol | C. | -46 kJ/mol | D. | -92 kJ/mol |
| A. | NaOH(NaOH) | B. | NaCl(HCl) | C. | CuCl2 (CuO) | D. | H2SO4 (H2SO4 ) |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
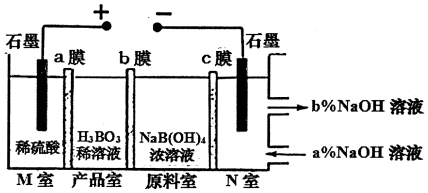
| A. | M室发生的电极反应式:2H2O-4e-═O2↑+4H+ | |
| B. | N室:a%<b% | |
| C. | 产品室发生的反应是:B(OH)4-+H+?H3BO3+H2O | |
| D. | 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体 |
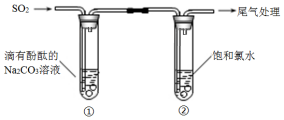
下列有关反应的方程式,不正确的是( )
| A. | ①中溶液显红色的原因:CO32-+H2O?HCO3-+OH- | |
| B. | ①中溶液红色褪去的原因:2SO2+CO32-+H2O═CO2+2HSO3- | |
| C. | ②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO | |
| D. | ②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl |
| 选项 | 实验 | 现象 | 结论 |
| A | 将硝酸亚铁加入稀硫酸中充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 硫酸有强氧化性 |
| B | Na[Al(OH)4]溶液中滴入NaHCO3 | 产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | Na2CO3溶液中滴入酚酞 | 溶液变红 | 能水解的盐溶液中的水的电离度一定比纯水的大 |
| D | 将少量氯水滴在淀粉-KI试纸上 | 试纸中间褪色,试纸边缘变蓝 | 氯气既有氧化性又有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 电解质 | B. | 非电解质 | C. | 强酸 | D. | 氧化物 |