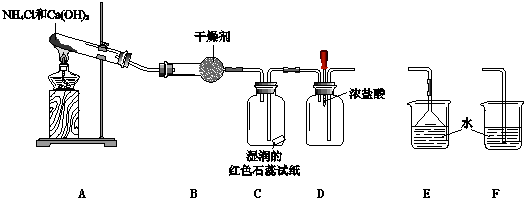
题目内容
16.下列说法正确的是( )| A. | 所有需要加热的反应都是吸热反应 | |
| B. | 所有金属元素形成的化合物都是离子化合物 | |
| C. | 所有主族元素的族序数等于其原子最外层上的电子数 | |
| D. | 所有共价化合物分子中每个原子最外层都达到稀有气体的稳定结构 |
分析 A、不能根据反应条件来判断反应吸放热;
B、金属和非金属元素形成的化合物不一定是离子化合物;
C、主族序数=最外层电子数;
D、共价化合物中的原子不一定均达2电子或8电子的稳定结构.
解答 解:A、不能根据反应条件来判断反应吸放热,即反应条件和吸放热之间无必然的联系,需要加热的反应不一定是吸热反应,吸热反应也不一定需要加热,故A错误;
B、金属和非金属元素形成的化合物不一定是离子化合物,故AlCl3,由金属和非金属元素构成,但为共价化合物,故B错误;
C、主族序数=最外层电子数,即元素处于第几主族,则其原子的最外层有几个电子,故C正确;
D、共价化合物中的原子不一定均达2电子或8电子的稳定结构,如PCl5中,P原子的最外层达10电子,故D错误.
故选C.
点评 本题考查了反应吸放热与反应条件之间的关系和元素周期表的有关知识,应注意的是元素处于第几主族,则原子的最外层有几个电子,但当原子的最外层有几个电子时,元素不一定处于第几主族.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
6.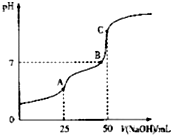 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有NaHC2O4和Na2C2O4 | |
| C. | A点时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | C点时,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
7.工业上曾经通过反应“3Fe+4NaOH$\stackrel{1100℃}{?}$Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是( )
| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
4.除去下列物质中所含少量杂质(括号内为杂质),所选的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
11. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是用蒸馏水后再用标准溶液润洗.
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
请计算待测烧碱溶液的浓度:0.08mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是用蒸馏水后再用标准溶液润洗.
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.00 |
5.某同学用15mol•L-1浓硫酸,按下列步骤配2505mL0.1mol•L-1H2SO4溶液,请回答有关问题.
(1)本实验不需要用到的仪器是c
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(2)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将偏低(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将不影响.
(3)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:
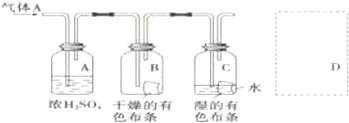
①浓硫酸的作用是干燥剂.
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是干燥氯气不具有漂白性从集气瓶C中湿润的有色布条的现象可得出的结论是次氯酸具有漂白性.
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(2)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将偏低(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将不影响.
(3)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:

①浓硫酸的作用是干燥剂.
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是干燥氯气不具有漂白性从集气瓶C中湿润的有色布条的现象可得出的结论是次氯酸具有漂白性.
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.
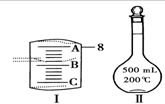 实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题: