题目内容
8.某小组利用以下装置制取并探究氨气的性质.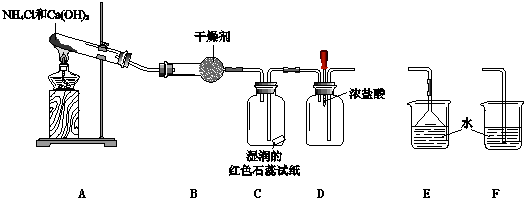
(1)A中反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)B中的干燥剂是碱石灰.
(3)C中的现象是试纸蓝色.
(4)实验进行一段时间后,挤压D装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是有白烟生成.
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是E(填“E”或“F”).
分析 实验室用加热氯化铵与氢氧化钙制备氨气,氨气为碱性气体,应选择碱性干燥剂,氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性,遇到石蕊能够使石蕊变蓝,氨气与氯化氢反应生成白色氯化铵固体,为防止氨气污染环境,应进行尾气处理,依据氨气极易溶于水的性质选择尾气处理装置.
解答 解:(1)加热氯化铵与氢氧化钙生成氯化钙、氨气和水,方程式;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气为碱性气体,应选择碱性干燥剂碱石灰干燥;
故答案为:碱石灰;
(3)氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子,溶液显碱性,遇到石蕊能够使石蕊变蓝,
故答案为:试纸蓝色;
(4)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产,反应方程式为NH3+HCl═NH4Cl,
故答案为:有白烟生成;
(5)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置,故选E;
故答案为:E.
点评 本题考查了氨气的制备及氨气的性质,掌握制备原理及氨气的性质是解题关键,题目难度不大,注意氨气吸收时应防止倒吸的发生.

练习册系列答案
相关题目
19.下列实验现象及结论正确的是( )
| A. | 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP(AgCl)>KSP(AgI) | |
| B. | Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka:H2CO3>H3BO3 | |
| C. | 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者 | |
| D. | 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
16.下列说法正确的是( )
| A. | 所有需要加热的反应都是吸热反应 | |
| B. | 所有金属元素形成的化合物都是离子化合物 | |
| C. | 所有主族元素的族序数等于其原子最外层上的电子数 | |
| D. | 所有共价化合物分子中每个原子最外层都达到稀有气体的稳定结构 |
3.下列现象或事实能用同一原理解释的是( )
| A. | 常温下铁和铂都不溶于浓硫酸 | |
| B. | 硫化钠和硅酸钠固体长期基露在空气中变质 | |
| C. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| D. | SO2 和漂白液都能使品红溶液褪色 |
20.下列有关能量的说法正确的是( )
| A. | 原电池将化学能转变为电能 | |
| B. | 原电池将电能转变为化学能 | |
| C. | 中和反应放热说明中和反应前后能量不守恒 | |
| D. | 吸热反应中生成物的总能量低于反应物的总能量 |
17.某元素X的气态氢化物的化学式为H2X,其最高价氧化物的水化物的化学式可能为( )
| A. | H2XO3 | B. | HXO3 | C. | HXO | D. | H2XO4 |
18.在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )
| A. | c(HCOO-)<c(Na+) | B. | c(HCOO-)>c(Na+) | C. | c(OH-)>c(HCOO-) | D. | c(OH-)<c(HCOO-) |

 .
.