题目内容
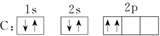
7.工业上曾经通过反应“3Fe+4NaOH$\stackrel{1100℃}{?}$Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是( )| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
分析 A、不能用磁铁可以将Fe与Fe3O4分离,两者都被吸引;
B、钠极易被空气中的氧气氧化;
C、该反应条件下铁的还原性比钠强;
D、每生成1molH2,转移的电子为4mol.
解答 解:A、不能用磁铁可以将Fe与Fe3O4分离,两者都被吸引,所以不能用磁铁将Fe与Fe3O4分离,故A错误;
B、钠极易被空气中的氧气氧化,故B错误;
C、该反应条件下铁的还原性比钠强,而不是氧化性,故C错误;
D、每生成1molH2,转移的电子为4mol,所以转移的电子数约为4×6.02×1023,故D正确;
故选D.
点评 本题考查氧化还原反应,明确元素化合价变化是解本题关键,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
2.下列说法正确的是( )
| A. | H与D,16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 | |
| B. | 元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y | |
| C. | 质量数相同的不同核素,一定属于不同种元素 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性依次减弱 |
12.下列离子在水溶液中能大量共存的是( )
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
19.下列实验现象及结论正确的是( )
| A. | 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP(AgCl)>KSP(AgI) | |
| B. | Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka:H2CO3>H3BO3 | |
| C. | 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者 | |
| D. | 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
16.下列说法正确的是( )
| A. | 所有需要加热的反应都是吸热反应 | |
| B. | 所有金属元素形成的化合物都是离子化合物 | |
| C. | 所有主族元素的族序数等于其原子最外层上的电子数 | |
| D. | 所有共价化合物分子中每个原子最外层都达到稀有气体的稳定结构 |
17.某元素X的气态氢化物的化学式为H2X,其最高价氧化物的水化物的化学式可能为( )
| A. | H2XO3 | B. | HXO3 | C. | HXO | D. | H2XO4 |

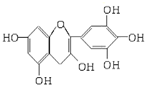 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )