题目内容
9.下列各组离子一定可以大量存在于指定溶液中的是( )| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
分析 A.加入铝粉产生无色无味气体的溶液为强碱或弱氧化性酸溶液;
B.能使石蕊试液变蓝色的溶液呈碱性,然后褪色,说明溶液中含有强氧化性微粒;
C.离子之间不反应的能大量共存;
D.加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小,说明溶液中存在盐类水解平衡,且盐类水解导致溶液呈酸性.
解答 解:A.加入铝粉产生无色无味气体的溶液为强碱或弱氧化性酸溶液,酸性条件下,硝酸根离子和Al反应生成氮氧化物而不是氢气,故A错误;
B.能使石蕊试液变蓝色的溶液呈碱性,然后褪色,说明溶液中含有强氧化性微粒,亚硫酸根离子、碘离子能被强氧化性微粒氧化,所以不能大量共存,故B错误;
C.Fe3+、SCN-生成络合物而不能大量共存,故C错误;
D.加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小,说明溶液中存在盐类水解平衡,且盐类水解导致溶液呈酸性,铝离子水解导致溶液呈酸性且加水稀释溶液酸性减弱,且离子之间不反应,所以一定大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,涉及络合反应、盐类水解、氧化还原反应等知识点,明确离子性质是解本题关键,注意隐含条件的挖掘,易错选项是AB.

练习册系列答案
相关题目
19.下列物质,中心原子的“杂化方式”及“分子空间构型”与CH2O(甲醛)相同的是( )
| A. | H2S | B. | NH3 | C. | CH2Br2 | D. | BF3 |
17.根据如图回答,下列说法正确的是( )
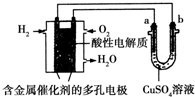

| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度减小 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+H2O═2OH- | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
4.在密闭容器中进行X2(g)+2Y2(g)?Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.9mol/L |
5.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4的浓度,化学反应速率增大;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=1.5×10-2mol/(L•min);
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图l所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
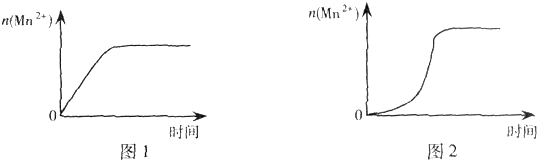
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4的浓度,化学反应速率增大;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=1.5×10-2mol/(L•min);
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图l所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
12.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如图实验:
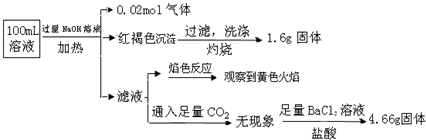
由此可知原溶液中( )

由此可知原溶液中( )
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| C. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
 (具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
(具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题: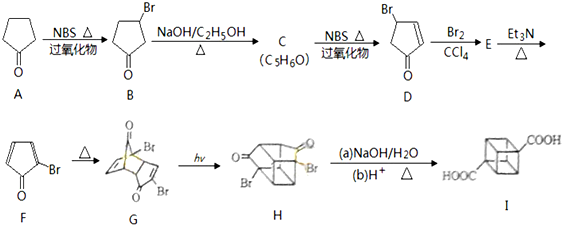
 ,E的结构简式为
,E的结构简式为 .
.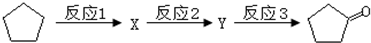
 :反应3可用的试剂为O2/Cu.
:反应3可用的试剂为O2/Cu.