题目内容
19.下列物质,中心原子的“杂化方式”及“分子空间构型”与CH2O(甲醛)相同的是( )| A. | H2S | B. | NH3 | C. | CH2Br2 | D. | BF3 |
分析 根据价层电子对互斥理论判断,价层电子对数等于σ键+孤电子对;HCHO中C原子成2个C-H键、1个C=O双键,杂化轨道数为3,C原子采取sp2杂化,O原子成1个C=O双键,含有2对孤电子对,杂化轨道数为3,O原子采取sp2杂化,甲醛分子中心原子为C原子,不含孤电子对,分子构型为平面三角形,利用价层电子对互斥理论结合各选项进行分析.
解答 解:HCHO中C原子成2个C-H键、1个C=O双键,中心原子为C原子,价层电子对个数=3+$\frac{1}{2}$(4-2×1-1×2)=3,且不含孤电子对,中心原子杂化方式为sp2,分子空间构型为平面三角形.
A.H2S分子中S原子价层电子对个数是4且含有2个孤电子对,所以S原子采用sp3杂化,为V形结构,故A错误;
B.氨气分子中N原子价层电子对个数是4且含有一个孤电子对,所以中心原子杂化方式是sp3、分子空间构型为三角锥形,故B错误;
C.CH2Br2分子中的C原子价层电子对个数是4,则C原子采取sp3杂化,分子构型为四面体形,故C错误;
D.BF3分子中B原子价层电子对个数是3且不含孤电子对,所以B原子采用sp2杂化,分子空间构型是平面三角形,故D正确;
故选D.
点评 本题考查杂化轨道、分子空间构型等,题目难度中等,注意理解杂化轨道理论与价层电子对互斥理论,进行分子构型的判断.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
9.可以用分液漏斗进行分离的混合物是( )
| A. | 酒精和碘水 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙醇和水 |
10.下列说法正确的是( )
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | Cl2的摩尔质量是71 g/mol | |
| C. | 标准状况下,22.4 L H2O的物质的量为1 mol | |
| D. | 1 mol H2的质量是1 g |
7.下列化合物中,含有共价键的离子化合物是( )
| A. | Na2S | B. | CaCl2 | C. | NaOH | D. | SO2 |
14.某原电池反应原理示意图如图.下列有关该原电池的说法正确的是( )
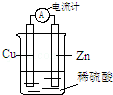

| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
11.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
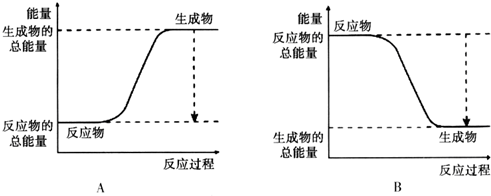
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.
(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
在理论上1molO2充分反应生成水放出热量(填吸收或放出)484kJ.
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.

(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
9.下列各组离子一定可以大量存在于指定溶液中的是( )
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
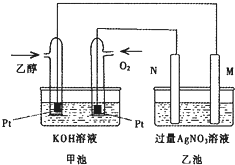 如图是个乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料分别是石墨和铁工作时M、N两个电极的质量都不减少,请回答:
如图是个乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料分别是石墨和铁工作时M、N两个电极的质量都不减少,请回答: