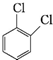
题目内容
9.现有FeSO4粗产品,已知其中仅含Fe2(SO4)3杂质,某兴趣小组进行如下探究实验:I.定性检测
检测粗产品中含有Fe2(SO4)3的实验方案是取少许粗产品配制成溶液,滴入几滴KCSN溶液,若观察到溶液出现血红色,则含有Fe2(SO4)3
Ⅱ.定量测定FeSO4的含量
实验流程如下:

(1)滴入BaCl2溶液发生的离子方程式为Ba2++SO42-═BaSO4↓.
(2)实验室需用460mL 1mol•L-1BaCl2溶液,配制该溶液时,应选择规格为500mL的容量瓶.
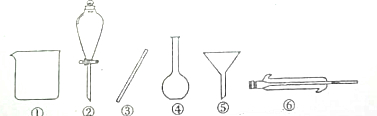
(3)操作Ⅰ的名称为过滤,需用到的玻璃仪器有①③⑤(填序号).
(4)通过计算,粗产品中FeSO4的百分含量为79.17%.
分析 (Ⅰ)粗产品中含有Fe2(SO4)3的检验,实质是对三价铁离子的检验,常用KCSN溶液检验,若溶液出现血红色,说明有三价铁离子;
(Ⅱ)(1)粗品配成溶液后,溶液中含有硫酸根离子,滴入BaCl2溶液中的钡离子与硫酸根反应生成硫酸钡沉淀;
(2)实验室中容量瓶的规格不是任意的,常见的有5ml、25ml、50ml、100ml、250ml、500ml、1000ml、2000ml,根据需要选择体积接近的容量瓶;
(3)分离溶液与沉淀的方法是过滤,用到的玻璃仪器有:烧杯、漏斗、玻璃棒;
(4)根据沉淀硫酸钡的质量算出物质的量,再根据硫酸根离子守恒建立关系式计算.
解答 解:(Ⅰ)粗产品中含有Fe2(SO4)3的检验,实质是对三价铁离子的检验,常用KCSN溶液检验,若溶液出现血红色,说明有三价铁离子,
故答案为:溶液出现血红色;
(Ⅱ)(1)粗品配成溶液后,溶液中含有硫酸根离子,滴入BaCl2溶液中的钡离子与硫酸根反应生成硫酸钡沉淀,反应方程式为:Ba2++SO42-═BaSO4↓,
故答案为:Ba2++SO42-═BaSO4↓;
(2)实验室中容量瓶的规格不是任意的,常见的有5ml、25ml、50ml、100ml、250ml、500ml、1000ml、2000ml,实验室需用460mL 1mol•L-1BaCl2溶液,配制该溶液时,应选择规格为500ml的容量瓶,
故答案为:500;
(3)分离溶液与沉淀的方法是过滤,用到的玻璃仪器有:烧杯、漏斗(注意不是分液漏斗)、玻璃棒;
故答案为:过滤;①③⑤;
(4)根据沉淀硫酸钡的质量算出物质的量为:n(BaSO4)=$\frac{m(BaS{O}_{4})}{M(BaS{O}_{4})}$=$\frac{30.29g}{233g•mo{l}^{-1}}$=0.13mol,设粗品中FeSO4的物质的量为a mol,Fe2(SO4)3的物质的量为 bmol,粗品总质量是19.20g,则有关系式:152a+400b=19.20①,根据硫酸根离子守恒建立关系式:a+3b=0.13②,根据①②解得a=0.10,b=0.01,则FeSO4的质量为:
m(FeSO4)=n(FeSO4)•M(FeSO4)=0.1mol×152g•mol-1=15.20g,所以粗产品中FeSO4的百分含量为:$\frac{硫酸亚铁的质量}{粗品的总质量}$×100%=$\frac{15.20}{19.20}$×100%=79.17%,
故答案为:79.17%.
点评 本题考查了三价铁离子的检验,沉淀法除杂以及离子方程式的书写,容量瓶的选择,过滤实验的操作,定量分析中纯度的计算,题目较简单.

| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.(1)臭氧是理想的烟气脱硝试剂,已知:
4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
3O2(g)?2O3(g)△H=+28.80kJ•mol-1
则脱硝反应2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=-42.75kJ•mol-1kJ•mol-1.
(2)若脱硝反应在恒容密闭容器中进行,下列说法正确的是abd.
a.升高温度,平衡常数减小
b.增大O3量可以提高NO2转化率
c.降低温度,既能提高NO2的转化率,又能加快反应速率
d.如图所示,t1时使用了催化剂
(3)某实验小组模拟合成甲醇的过程,将6molCO2和8molH2充入一容积为2L的密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=-49.0kJ•mol-1.测得H2的物质的量随时间变化如下表所示,回答下列问题:
| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
(4)根据阿伦尼乌斯公式可知.化学反应速率常数随温度变化的关系为k=Ae(-Ea/Rr)(其中Ea为活化能,R为常量,A为大于零的常数),在相同温度下,活化能Ea越大,化学反应速率常数k越小(填“越大”或“越小”)
(5)某研究小组用熔断Li2CO3作电解质,电解还原CO2制石墨,电解过程中阴极的电极反应式3CO2+4e-=C+CO32-.
 、
、