题目内容
17.根据如图回答,下列说法正确的是( )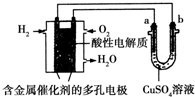
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度减小 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+H2O═2OH- | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
分析 氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,和正极相连的是电解池的阳极,和负极相连的是电解池的阴极;电镀时,电解质溶液中离子浓度不变,电解精炼铜时,粗铜作阳极,精铜作阴极,根据得失电子守恒进行计算.
解答 解:氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,故b极为阴极,a极为阳极.
A.铁表面镀铜时,金属铜必须作阳极,金属铁作阴极,所以a为金属铜,故A错误;
B.此装置用于电镀铜时,金属铜必须作阳极,电解前后硫酸铜溶液的浓度不变,故B错误;
C.氢氧燃料电池中,通入氧气的电极一定是正极,在酸性环境下,氧气放电的反应为:$\frac{1}{2}$O2+2H++2e-=H2O,故C错误;
D.电解精炼铜时,粗铜作阳极,精铜作阴极,1mol水生成,转移2mol电子,可得到64g铜,故D正确.
故选D.
点评 本题考查了氢氧燃料电池的工作原理和电解精炼铜、电镀原理等知识,难度不大,注意把握电极的判断和电极方程式的书写方法.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
7.下列化合物中,含有共价键的离子化合物是( )
| A. | Na2S | B. | CaCl2 | C. | NaOH | D. | SO2 |
5.下列有机物命名正确的是( )
| A. |  2-甲基-1-丙醇 | B. |  2-甲基-2-氯丙烷 | C. |  1,3,4-三甲苯 | D. |  2-甲基-3-丁烯 |
12.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃只有一种的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
2.被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光.已知草酸二酯的结构如图所示,下列有关说法正确的是( )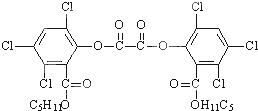

| A. | 1 mol草酸二酯与NaOH稀溶液反应(苯环上卤素不水解),最多可消耗10 mol NaOH | |
| B. | 草酸二酯水解时生成两种有机物 | |
| C. | 1 mol草酸二酯与H2完全反应,需要H2 6 mol | |
| D. | 草酸二酯的分子式为C26H22Cl6O8 |
9.下列各组离子一定可以大量存在于指定溶液中的是( )
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
17.对于某些离子和物质的检验及结论一定正确的是( )
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |