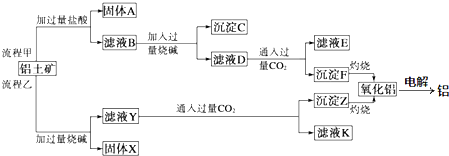
题目内容
4.在密闭容器中进行X2(g)+2Y2(g)?Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.9mol/L |
分析 X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,如果该反应向正反应方向进行,则X2、Y2浓度降低、Z浓度增大,如果该反应向逆反应方向进行,则该反应中Z浓度降低而X2、Y2浓度增大,采用极限法分析解答.
解答 解:X2、Y2、Z的起始浓度依次为0.2 mol/L、0.3mol/L、0.3mol/L,如果该反应向正反应方向进行,则X2、Y2浓度降低、Z浓度增大,如果该反应向逆反应方向进行,则该反应中Z浓度降低而X2、Y2浓度增大,
①如果该反应向正反应方向进行,且Y2完全反应,
X2(g)+2Y2(g)?Z(g)
开始(mol/L)0.2 0.3 0.3
反应(mol/L)0.15 0.3 0.15
反应末(mol/L)0.05 0 0.45
②如果该反应向逆反应方向进行,且Z完全反应,
X2(g)+2Y2(g)?Z(g)
开始(mol/L)0.2 0.3 0.3
反应(mol/L)0.3 0.6 0.3
反应末(mol/L)0.5 0.9 0
实际上该反应可能向正反应方向进行也可能向逆反应方向进行,①中X2、Y2浓度最小而Z浓度最大,②中X2、Y2浓度最大而Z浓度最小,实际上这几种物质浓度介于最大和最小之间,
即0.05<c(X2)<0.5、0<c(Y2)<0.9、0<c(Z)<0.45,
故选B.
点评 本题考查化学平衡有关计算,为高频考点,侧重考查学生分析计算能力,把握可逆反应的不完全性是解本题关键,采用极限法分析解答,题目难度不大.

练习册系列答案
相关题目
14.某原电池反应原理示意图如图.下列有关该原电池的说法正确的是( )
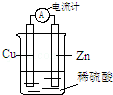

| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
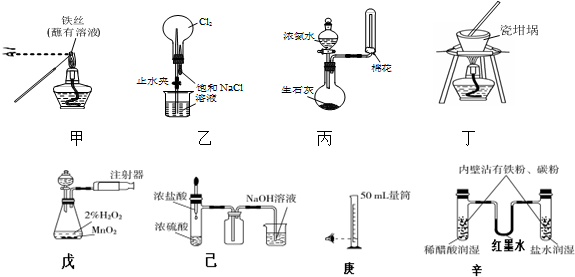
①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.

①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
12.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃只有一种的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
9.下列各组离子一定可以大量存在于指定溶液中的是( )
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
4.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、SiO${\;}_{3}^{2-}$.现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
 ;②二氧化碳
;②二氧化碳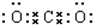 .③氯化镁的形成过程:
.③氯化镁的形成过程: ;④次氯酸的形成过程:
;④次氯酸的形成过程: .
.