题目内容
12.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如图实验: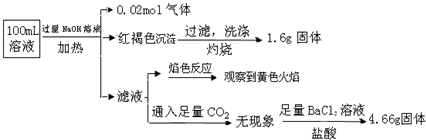
由此可知原溶液中( )
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| C. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;
颜色反应为黄色,则溶液中存在钠离子,由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子;
根据溶液电中性判断是否存在氯离子.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
颜色反应为黄色,则溶液中一定存在钠离子,由于加入了NaOH,无法判断原溶液中是否含有Na+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,
据电荷守恒,原溶液中一定有Cl-,物质的量至少为 0.02mol×2+0.02mol-0.02mol×2=0.02mol,
A.根据以上分析可知,原溶液中含有0.02mol铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
B.根据以上分析,原溶液中一定存在0.02molNH4+,0.02molSO42-,0.02molFe3+、Fe2+中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为:0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl-,且c(Cl-)≥$\frac{0.06mol-0.04mol}{0.1L}$=0.2 mol•L-1,故B正确;
C.根据以上分析可知,原溶液中一定存在SO42-、NH4+、Cl-,只是存在Fe3+、Fe2+中的一种,其离子的物质的量为0.02mol,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故C错误;
D.检验亚铁离子时,取少量原溶液于试管中,加KSCN溶液,此时溶液现象必须是无色,然后再加入适量氯水,溶液呈血红色,则含有Fe2+,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故D错误;
故选B.
点评 本题考查物质分离、提纯实验方案的设计,为高频考点,把握实验流程中的试剂、发生的反应及分离方法为解答的关键,侧重分析能力、实验能力的综合考查,题目难度不大,注意根据溶液电中性判断氯离子存在的方法.

 名校课堂系列答案
名校课堂系列答案(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.
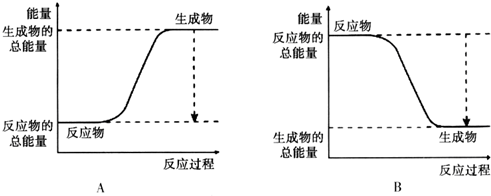
(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
| A. | CH3Cl | B. |  | C. |  | D. |  |
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化.
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成.过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成.
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-.
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-${\;}_{3}^{-}$+OH--→AlO2-+NH3+N2+H2O(未配平).还原产物是NH3和N2.若除去0.2molNO3-,要消耗铝9.6g.
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理.下列处理措施和方法中正确的是AD.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.(1)臭氧是理想的烟气脱硝试剂,已知:
4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
3O2(g)?2O3(g)△H=+28.80kJ•mol-1
则脱硝反应2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=-42.75kJ•mol-1kJ•mol-1.
(2)若脱硝反应在恒容密闭容器中进行,下列说法正确的是abd.
a.升高温度,平衡常数减小
b.增大O3量可以提高NO2转化率
c.降低温度,既能提高NO2的转化率,又能加快反应速率
d.如图所示,t1时使用了催化剂
(3)某实验小组模拟合成甲醇的过程,将6molCO2和8molH2充入一容积为2L的密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=-49.0kJ•mol-1.测得H2的物质的量随时间变化如下表所示,回答下列问题:
| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
(4)根据阿伦尼乌斯公式可知.化学反应速率常数随温度变化的关系为k=Ae(-Ea/Rr)(其中Ea为活化能,R为常量,A为大于零的常数),在相同温度下,活化能Ea越大,化学反应速率常数k越小(填“越大”或“越小”)
(5)某研究小组用熔断Li2CO3作电解质,电解还原CO2制石墨,电解过程中阴极的电极反应式3CO2+4e-=C+CO32-.
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |