题目内容
20.立方烷 (具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题:
(具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:回答下列问题: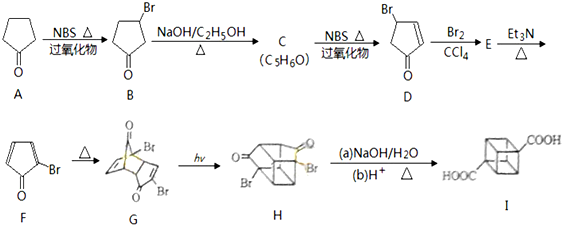
(1)C的结构简式为
 ,E的结构简式为
,E的结构简式为 .
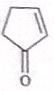
.(2)化合物A可由环戊烷经三步反应合成
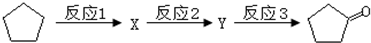
反应1的试剂与条件为Cl2/光照:反应2的化学方程式为
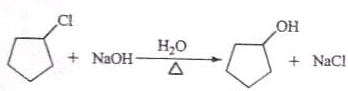 :反应3可用的试剂为O2/Cu.
:反应3可用的试剂为O2/Cu.(3)在I的合成路线中,互为同分异构体的化合物是G、H(填化合物代号).
(4)I与碱石灰共热可转化为立方烷,立方烷的核磁共振氢谱中有1个峰.
(5)立方烷经硝化可得到六硝基立方烷,其可能的结构有3种.
分析 A发生取代反应生成B,B消去反应生成C,结合D的结构可知C为 ,C发生取代反应生成D,E生成F,根据F和D的结构简式知,D发生加成反应生成E为
,C发生取代反应生成D,E生成F,根据F和D的结构简式知,D发生加成反应生成E为 ,E发生消去反应生成F,F发生加成反应生成G,G发生加成反应生成H,H发生反应生成I,再结合问题分析解答.
,E发生消去反应生成F,F发生加成反应生成G,G发生加成反应生成H,H发生反应生成I,再结合问题分析解答.
解答 解:A发生取代反应生成B,B消去反应生成C,结合D的结构可知C为 ,C发生取代反应生成D,E生成F,根据F和D的结构简式知,D发生加成反应生成E为
,C发生取代反应生成D,E生成F,根据F和D的结构简式知,D发生加成反应生成E为 ,E发生消去反应生成F,F发生加成反应生成G,G发生加成反应生成H,H发生反应生成I.
,E发生消去反应生成F,F发生加成反应生成G,G发生加成反应生成H,H发生反应生成I.
(1)C的结构简式为 ,E的结构简式为
,E的结构简式为 ,
,
故答案为: ;
; ;
;
(2)环戊烷和氯气在光照条件下发生取代反应生成X ,
, 和氢氧化钠的水溶液发生取代反应生成Y为
和氢氧化钠的水溶液发生取代反应生成Y为 ,
, 在铜作催化剂加热条件下发生氧化反应生成
在铜作催化剂加热条件下发生氧化反应生成 ,所以反应I的试剂和条件为Cl2/光照,反应2的化学方程式为
,所以反应I的试剂和条件为Cl2/光照,反应2的化学方程式为 ,反应3可用的试剂为O2/Cu,
,反应3可用的试剂为O2/Cu,
故答案为:Cl2/光照; ;O2/Cu;
;O2/Cu;
(3)在I的合成路线中,互为同分异构体的化合物是G和H,故答案为:G和H;
(4)I与碱石灰共热可化为立方烷,核磁共振氢谱中氢原子种类与吸收峰个数相等,立方烷中氢原子种类是1,所以立方烷的核磁共振氢谱中有1个峰,故答案为:1;
(5)立方烷经硝化可得到六硝基立方烷,两个H原子可能是相邻、同一面的对角线顶点上、通过体心的对角线顶点上,所以其可能的结构有3种,
故答案为:3.
点评 本题考查了有机物的合成,涉及反应条件的判断、反应方程式的书写、同分异构体种类的判断等知识点,明确有机物中含有的官能团及其性质是解本题关键,题目难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
10.下列说法正确的是( )
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | Cl2的摩尔质量是71 g/mol | |
| C. | 标准状况下,22.4 L H2O的物质的量为1 mol | |
| D. | 1 mol H2的质量是1 g |
11.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
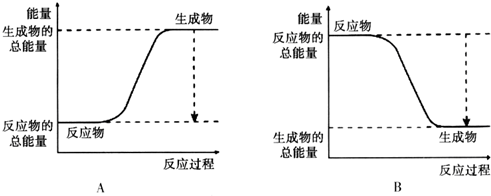
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.
(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
在理论上1molO2充分反应生成水放出热量(填吸收或放出)484kJ.
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.

(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
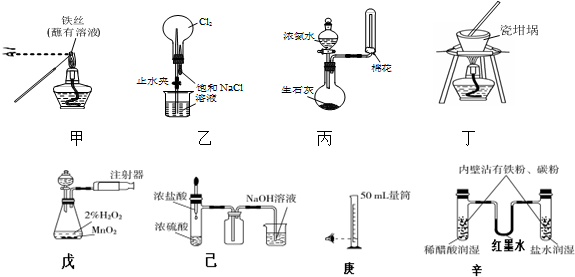
①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.

①用装置甲检验溶液中是否有K+ ②用装置丙制取并收集少量NH3
③用装置乙进行喷泉实验 ④用装置丁加热熔融NaOH固体
⑤装置戊测定化学反应速率 ⑥装置己制取并吸收HCl
⑦装置庚量取8.5mL的稀硫酸 ⑧装置辛模拟铁的腐蚀.
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
5.下列有机物命名正确的是( )
| A. | 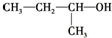 2-甲基-1-丙醇 | B. | 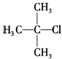 2-甲基-2-氯丙烷 | C. | 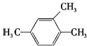 1,3,4-三甲苯 | D. | 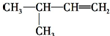 2-甲基-3-丁烯 |
12.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃只有一种的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
9.下列各组离子一定可以大量存在于指定溶液中的是( )
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
1. 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
(1)臭氧是理想的烟气脱硝试剂,已知:
4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
3O2(g)?2O3(g)△H=+28.80kJ•mol-1
则脱硝反应2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=-42.75kJ•mol-1kJ•mol-1.
(2)若脱硝反应在恒容密闭容器中进行,下列说法正确的是abd.
a.升高温度,平衡常数减小
b.增大O3量可以提高NO2转化率
c.降低温度,既能提高NO2的转化率,又能加快反应速率
d.如图所示,t1时使用了催化剂
(3)某实验小组模拟合成甲醇的过程,将6molCO2和8molH2充入一容积为2L的密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=-49.0kJ•mol-1.测得H2的物质的量随时间变化如下表所示,回答下列问题:
该反应在0~8min内生成CH3OH的平均反应速率是0.125mol•L-1•min-1;该反应的平衡常数为K=0.5;其他条件不变,将12molCO2和16molH2充入密闭容器中反应,则H2是转化率会增大(填“增大”、“减小”或“不变”).
(4)根据阿伦尼乌斯公式可知.化学反应速率常数随温度变化的关系为k=Ae(-Ea/Rr)(其中Ea为活化能,R为常量,A为大于零的常数),在相同温度下,活化能Ea越大,化学反应速率常数k越小(填“越大”或“越小”)
(5)某研究小组用熔断Li2CO3作电解质,电解还原CO2制石墨,电解过程中阴极的电极反应式3CO2+4e-=C+CO32-.
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.(1)臭氧是理想的烟气脱硝试剂,已知:
4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
3O2(g)?2O3(g)△H=+28.80kJ•mol-1
则脱硝反应2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=-42.75kJ•mol-1kJ•mol-1.
(2)若脱硝反应在恒容密闭容器中进行,下列说法正确的是abd.
a.升高温度,平衡常数减小
b.增大O3量可以提高NO2转化率
c.降低温度,既能提高NO2的转化率,又能加快反应速率
d.如图所示,t1时使用了催化剂
(3)某实验小组模拟合成甲醇的过程,将6molCO2和8molH2充入一容积为2L的密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=-49.0kJ•mol-1.测得H2的物质的量随时间变化如下表所示,回答下列问题:
| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
(4)根据阿伦尼乌斯公式可知.化学反应速率常数随温度变化的关系为k=Ae(-Ea/Rr)(其中Ea为活化能,R为常量,A为大于零的常数),在相同温度下,活化能Ea越大,化学反应速率常数k越小(填“越大”或“越小”)
(5)某研究小组用熔断Li2CO3作电解质,电解还原CO2制石墨,电解过程中阴极的电极反应式3CO2+4e-=C+CO32-.