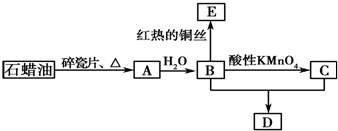
题目内容
9.在标准状况下,4.48LC2H4气体的物质的量为0.2mol,质量为5.6g,分子数为0.2NA个,含有3.2mol电子.含有0.8mol H原子,H 原子的质量为0.8g.分析 依据n=$\frac{m}{M}$=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$结合1个乙烯分子含有16个电子,含有4个氢原子解答.
解答 解:在标准状况下,4.48LC2H4气体物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol;质量为:0.2mol×28g/mol=5.6g;分子数为:0.2mol×NA=0.2NA;含有电子数为:0.2mol×16=3.2mol;含有氢原子物质的量为:0.2mol×4=0.8mol;氢原子质量为:0.8mol×1g/mol=0.8g;
故答案为:0.2;5.6;0.2NA;3.2;0.8;0.8.
点评 本题考查了有关物质的量计算,熟悉以物质的量为核心的相关计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
19.下列有机物的命名正确的一组是( )
| A. | 二溴乙烷  | B. | 3-乙基-1-丁烯  | ||
| C. | 2-甲基-2,4-己二烯  | D. | 2,2,3-三甲基戊烷  |
17.下列物质的变化所破坏的作用力相同的是( )
| A. | NaCl和HCl溶于水都电离成离子 | B. | SiO2和冰块的熔化 | ||
| C. | 晶体硫的熔化和晶体碘的升华 | D. | 酒精和冰醋酸溶于水 |
1.下列离子方程式正确的是( )
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 将Na2O2固体投入H218O中:2Na2O2+H218O═Na++4OH-+8O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+BaSO4↓ | |
| D. | 用石墨作两电极电解MgCl2溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$C12↑+2OH-+H2↑ |
19.下列说法中错误的是( )
| A. | SO2和SO3都是极性分子 | |
| B. | 在NH4+和H3O+中都存在配位键 | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,普遍具有熔点高硬度大的特性 |