题目内容
14.如图各方框表示有关的一种反应物或生成物(某些生成物已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝.
(1)写出化学式:X:NH4HCO3或(NH4)2CO3F:NO2
(2)写出下列变化的方程式:A→D(化学方程式)2CO2+2Na2O2=2Na2CO3+O2;G→E(离子方程式表示):3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)实验室里,常用加热铵盐和碱【或NH4Cl和Ca(OH)2】的混合物的方法制取气体C,常采用向下排空气法法来收集气体C.
分析 C能使湿润的红色石蕊试纸变蓝,应为NH3,D为O2,E为NO,F为NO2,则B应为H2O,G为HNO3,A可与Na2O2反应生成O2,则A应为CO2,X可能为NH4HCO3或(NH4)2CO3,结合相关物质的性质解答该题.
解答 解:C能使湿润的红色石蕊试纸变蓝,应为NH3,D为O2,E为NO,F为NO2,则B应为H2O,G为HNO3,A可与Na2O2反应生成O2,则A应为CO2,X可能为NH4HCO3或(NH4)2CO3,
(1)由以上分析可知X可能为NH4HCO3或(NH4)2CO3,F为NO2,
故答案为:NH4HCO3或(NH4)2CO3;NO2;
(2)A→D为Na2O2和CO2的反应,方程式为2CO2+2Na2O2=2Na2CO3+O2,
G→E为稀硝酸和铜的反应,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:2CO2+2Na2O2=2Na2CO3+O2;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)C为NH3,密度比空气小,易溶于水,常用向下排空气法收集,实验室用铵盐和碱【或NH4Cl和Ca(OH)2】在加热条件下制备氨气,
故答案为:铵盐和碱【或NH4Cl和Ca(OH)2】;向下排空气法.
点评 本题考查无机物的推断,题目难度不大,本题注意根据C的性质为突破口进行解答,注意相关物质的性质,学习中注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.1克氢气燃烧生成液态水放出142.9kJ热,该反应的热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-142.9 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 2H2+O2=2H2O;△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-285.8 kJ•mol-1 |
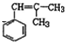
2.下列有机物系统命名正确的是( )
| A. | 2-甲基-氯丙烷 | B. | 2-甲基-3-丁烯 | ||
| C. |  1,3,4-三甲苯 1,3,4-三甲苯 | D. | 2,3-二甲基-4-乙基己烷 |
3.下列图示与对应的叙述不相符的是( )

| A. | 图1中正极电极反应式为:O2+4e-+4H+=2H2O | |
| B. | 图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| C. | 图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化 |
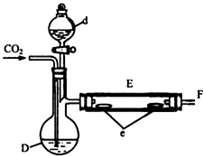 实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答:
实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答: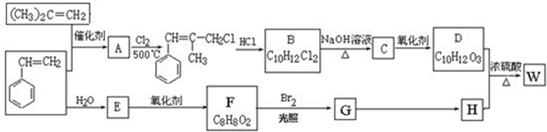

 ;W的结构简式:
;W的结构简式: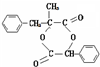 .
.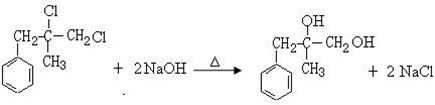 ;由D生成高分子化合物的方程式
;由D生成高分子化合物的方程式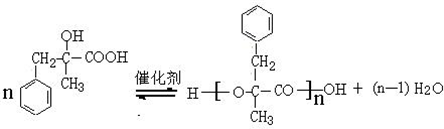 .
.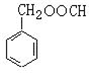 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1. 原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题: