题目内容
18.配制一定浓度溶液定容时俯视刻度线,所配溶液的浓度偏大(填偏大、偏小或无影响)分析 定容时俯视刻度线,溶液体积V偏小,结合c=$\frac{n}{V}$分析.
解答 解:定容时俯视刻度线,溶液体积V偏小,c=$\frac{n}{V}$ 可知,n不变,V偏小,则c偏大,
故答案为:偏大.
点评 本题考查一定物质的量浓度的溶液配制及计算,为高频考点,把握浓度、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意误差分析,题目难度不大.

练习册系列答案
相关题目
8.某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质.某化学课外小组设计如图流程,取该矿样为原料生产CuC12•2H2O 晶体.
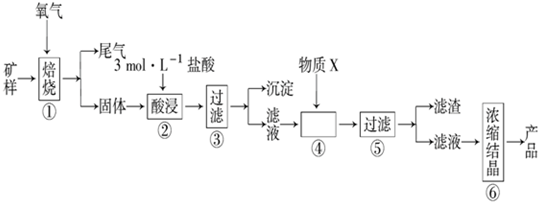
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 如表.
回答下列问题:
(l)步骤①的焙烧过程中需要通入氧气.在实验室中,可使用常见化学物质利用如图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑.
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:2(NH4)2SO3+O2═2(NH4)2SO4、2NH4HSO3+O2═2NH4HSO4.
(3)步骤②酸浸过程中,需要用到3mol•L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100ml的容量瓶,量筒.
(4)步骤④加入物质X的目的是控制溶液的pH,使Fe3+以沉淀的形式全部沉淀,物质X 可以选用下列物质中的D.
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol•L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=1×10-15.

已知:常温下,金属离子开始沉淀和沉淀完全时的pH 如表.
| 金属 离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(l)步骤①的焙烧过程中需要通入氧气.在实验室中,可使用常见化学物质利用如图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑.
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:2(NH4)2SO3+O2═2(NH4)2SO4、2NH4HSO3+O2═2NH4HSO4.
(3)步骤②酸浸过程中,需要用到3mol•L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100ml的容量瓶,量筒.
(4)步骤④加入物质X的目的是控制溶液的pH,使Fe3+以沉淀的形式全部沉淀,物质X 可以选用下列物质中的D.
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol•L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=1×10-15.
13.四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图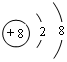 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
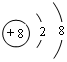 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
3.下列图示与对应的叙述不相符的是( )

| A. | 图1中正极电极反应式为:O2+4e-+4H+=2H2O | |
| B. | 图2表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| C. | 图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示向NH4 Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,生成沉淀总物质的量(n)随着Ba(OH)2溶液体积(y)的变化 |
10.下列关于物质分类的说法正确的是( )
| A. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| B. | 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等 | |
| C. | 镁铝合金、漂白粉、水玻璃、王水均为混合物 | |
| D. | 纯碱、熟石灰、醋酸、食盐水均为电解质 |
7.化学与生产、生活息息相关.下列说法不正确的是( )
| A. | 推广碳捕集和储存技术,逐步实现 CO2的零排放 | |
| B. | 乙醇不能用于消毒杀菌 | |
| C. | 用 Na2S 除去工业废水中的 Cu2+离子 | |
| D. | 晶体硅可用于制造太阳能电池 |
8.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| C. | 过氧化钠固体与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向氢氧化钠溶液中通入足量的CO2气体:CO2+2OH-═CO32-+H2O |
 原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题: