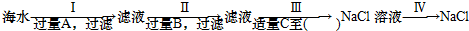题目内容
4.下列叙述中正确的是②③⑥(填序号)①标准状况下,1L HCl和1L H2O的物质的量相同;
②通常状况下的气体摩尔体积大于22.4L/mol;
③在同温同体积时,气体物质的物质的量越大,则压强越大;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤相同条件下,气体物质的量越大,气体摩尔体积越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比.
分析 ①标准状况下,H2O不是气体;
②标准状况即0℃、101KP时,气体摩尔体积为22.4L/mol;
③在同温同体积时,气体压强与物质的量成正比;
④两种物质不一定都是气体;
⑤相同条件下,气体摩尔体积为常数;
⑥同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比.
解答 解:①标准状况下,HCl为气体,而H2O不是气体,二者体积相等,它们物质的量不相等,故错误;
②标况即0℃、101KP时,气体摩尔体积为22.4L/mol,故通常状况下,由于温度高于0℃,故气体摩尔体积大于22.4L/mol,故正确;
③在同温同体积时,气体压强与物质的量成正比,所以在同温同体积时,气体物质的物质的量越大,则压强越大,正确;
④标况下,两种物质不一定都是气体,它们物质的量相等,占有的体积不一定相等,故错误;
⑤相同条件下,气体物质的量越大,气体的体积越大,但是气体摩尔体积为常数,故错误;
⑥同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比,即气体的密度与气体的相对分子质量成正比,故正确.
故答案为:②③⑥.
点评 本题考查阿伏伽德罗定律及其推论,注意根据PV=nRT理解阿伏伽德罗定律及其推论、温度及压强对气体摩尔体积的影响,难度中等.

练习册系列答案
相关题目
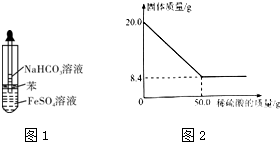
15.区别固体Na2CO3和NaHCO3最好的方法是( )
| A. | 加澄清的石灰水 | B. | 两者分别与同浓度的稀盐酸反应 | ||
| C. | 溶于水,比较其溶解性 | D. | 两者分别加入NaOH溶液 |
19.下列离子方程式正确的是( )
| A. | 钠和水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸氢钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 工业上电解饱和食盐水的反应:2Na++2Cl-$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
13.四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图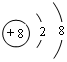 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
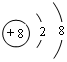 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
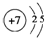 .
.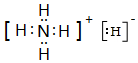 .
.
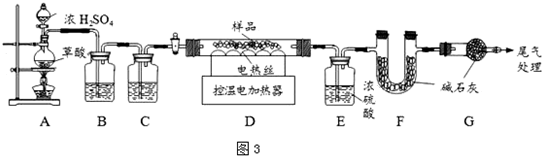
 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题: 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.