题目内容
6.某同学设计了如图的实验: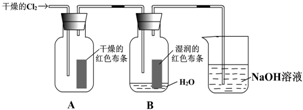
(1)氯气是一种黄绿色、有刺激性气味的有毒气体.若贮有氯气的钢瓶损坏,造成氯气泄露,在场人员除了采取有效措施外,其他人员应B(选字母).
A、向低洼处转移 B、向地势高处转移
(2)装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条褪色.由此可得出的结论是干燥Cl2没有漂白性,Cl2与水反应生成HClO有漂白性.
(3)上述装置烧杯中盛放溶液的作用是吸收尾气,防止污染空气.写出烧杯中发生反应的化学方程式Cl2+2NaOH═NaCl+NaClO+H2O.
(4)Fe在Cl2中燃烧,生成棕褐色的烟,要检验其溶液中是否存在Fe3+,可向其中滴入几滴KSCN溶液,观察到的现象是溶液变为红色.若先向溶液中加入少量铁粉,充分反应后再滴入几滴KSCN溶液,结果观察不到此现象,原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
分析 (1)依据氯气是黄绿色气体,密度大于空气密度,有毒的物理性质解答;
(2)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,据此解答;
(3)氯气有毒,直接排放到空气中容易造成空气污染,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水;
(4)三价铁离子遇到KSCN溶液显血红色,三价铁离子与铁反应生成二价铁离子.
解答 解:(1)氯气是黄绿色气体,密度大于空气密度,氯气泄露,向地势高处转移,故答案为:黄绿; B;
(2)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条褪色;
故答案为:褪色; 干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;
(3)氯气有毒,直接排放到空气中容易造成空气污染,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水,反应方程式:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:吸收尾气,防止污染空气; Cl2+2NaOH═NaCl+NaClO+H2O;
(4)三价铁离子遇到KSCN溶液显血红色,通常用KSCN溶液检验三价铁离子,三价铁离子与铁反应生成二价铁离子,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:溶液变为红色; 2Fe3++Fe=3Fe2+.
点评 本题考查了元素化合物知识,明确氯气、氯水的成分及性质是解题关键,注意三价铁离子、二价铁离子的影响,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
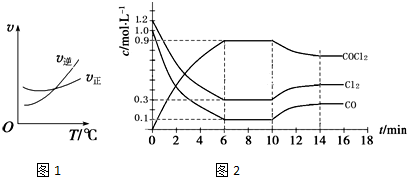
14.一定条件下,在密闭容器中进行下列反应:
NO(g)+CO(g)═$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
NO(g)+CO(g)═$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 降低温度同时增大压强 | ||
| C. | 充入CO | D. | 加催化剂同时增大压强 |
1.某合作学习小组讨论辨析以下说法:
①铝热剂和漂白粉都是混合物;
②金属氧化物都是碱性氧化物;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
上述说法正确的是( )
①铝热剂和漂白粉都是混合物;
②金属氧化物都是碱性氧化物;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
上述说法正确的是( )
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
11.下列6个转化,其中不能通过一步反应实现的是
①SiO2→Na2SiO3 ②Fe(OH)2-→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3-→Al(OH)3 ⑤Na2O2→NaCl ⑥Al→NaAlO2( )
①SiO2→Na2SiO3 ②Fe(OH)2-→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3-→Al(OH)3 ⑤Na2O2→NaCl ⑥Al→NaAlO2( )
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
18.现有常温下的四份溶液:①0.01mol•L-1 CH3COOH溶液;②0.01mol•L-1盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
16.在配制一定物质的量浓度的溶液时,不会用到的仪器是( )
| A. |  | B. |  | C. |  | D. |  |
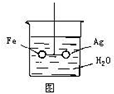 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.