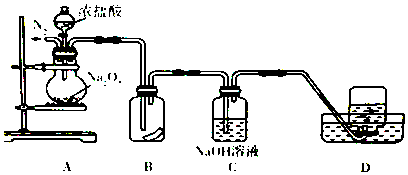
题目内容
3.A、B、C、D是原子序数依次增大的短周期元素,化合物AC2与B2C具有相同的电子数,A、B的质子数之和与D的质子数相同,D与C形成的化合物既能与强酸反应又能与强碱反应,回答下列问题(1)写出D的原子结构示意图
 ,AC2的电子式
,AC2的电子式
(2)写出D与C形成的化合物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O
(3)14g化合物AC与足量的C2单质反应放出141.5kJ的热量,该反应的热化学方程式为CO(g)+$\frac{1}{2}$O2=CO2(g)△H=283kJ/mol
(4)B的最高氧化物对应的水化物M,M与第四周期常见金属X有如下转化关系:
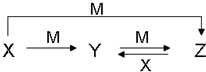
写出Y与M的稀溶液反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2OZ溶液显酸性,其原因用离子方程式表示为Fe3++3H2O?Fe(OH)3+3H+.
分析 D与C形成的化合物既能与强酸反应又能与强碱反应,应为两性化合物,短周期元素可形成Al2O3,则C为O元素,A为Al元素,化合物AC2与B2C具有相同的电子数,A、B的质子数之和与D的质子数相同,可知A为C元素,B为N元素,
(1)D为Al,元素核外有3个电子层,最外层电子数为3,AC2为二氧化碳;
(2)D与C形成的化合物为氧化铝,为两性氧化物,可与强碱反应;
(3)14g化合物AC为0.5molCO,与足量的C2单质反应放出141.5kJ的热量,以此可书写热化学方程式;
(4)由转化关系可知X为变价金属,应为Fe,则M为HNO3,Y为Fe(NO3)2,Z为Fe(NO3)3,以此解答该题.
解答 解:D与C形成的化合物既能与强酸反应又能与强碱反应,应为两性化合物,短周期元素可形成Al2O3,则C为O元素,A为Al元素,化合物AC2与B2C具有相同的电子数,A、B的质子数之和与D的质子数相同,可知A为C元素,B为N元素,
(1)D为Al,元素核外有3个电子层,最外层电子数为3原子结构示意图为 ,AC2为二氧化碳,电子式为
,AC2为二氧化碳,电子式为 ,
,
故答案为: ;
; ;
;
(2)D与C形成的化合物为氧化铝,为两性氧化物,可与强碱反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)14g化合物AC为0.5molCO,与足量的C2单质反应放出141.5kJ的热量,热化学方程式为CO(g)+$\frac{1}{2}$O2=CO2(g)△H=283kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2=CO2(g)△H=283kJ/mol;
(4)由转化关系可知X为变价金属,应为Fe,则M为HNO3,Y为Fe(NO3)2,Z为Fe(NO3)3,
Y与M的稀溶液反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
Fe(NO3)3为强酸弱碱盐,水解呈酸性,离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;酸;Fe3++3H2O?Fe(OH)3+3H+.
点评 本题考查元素推断、元素周期律等知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意把握相关物质的性质,为解答该题的关键.

 培优三好生系列答案
培优三好生系列答案①盛满二氧化氮的烧瓶浸入热水中颜色变深 ②新制的氯水在光照条件下颜色变浅
③在H2、I2和HI组成的平衡体系中,加压,混合气体颜色变深 ④可用浓氨水和氢氧化钠固体快速制取氨气
⑤高锰酸钾溶液加水稀释后颜色变浅 ⑥加催化剂有利于氨氧化反应
⑦500℃左右比室温更有利于合成氨的反应 ⑧收集氯气用排饱和食盐水的方法.
| A. | ②③⑤⑥ | B. | ③⑤⑥⑧ | C. | ③⑤⑥⑦ | D. | ④⑥⑦⑧ |
| A. | 0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO42- | |
| B. | 使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4- | |
| C. | 使酚酞变红的溶液中:Na+、Cu2+、HCO3-、NO3- | |
| D. | 无色溶液中:K+、Ca2+、Cl-、NO3- |
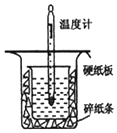 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 序号 | 起始温度t1/℃ | 终止温度t2/℃ | t2-t1均值 | ||
| H2SO4 | NaOH | 均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29,6 | |
| 2 | 29.0 | 29.4 | 29,2 | 32.9 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所求中和热相等(填“相等”“不相等”)
(3)结合实验数据填空:
①由表中数据可知反应前后溶液的平均温度差,即t2-t1的均值为:3.5℃.
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-58.52 kJ/mol.
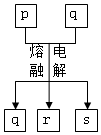 短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同.p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质.这些物质间的转化关系如图所示.下列说法不正确的是( )| A. | 原子半径:Y>Z>W>X | |
| B. | q属于离子化合物 | |
| C. | p能与盐酸反应,但不能与氢氧化钠溶液反应 | |
| D. | 一定条件下,r与s能发生化合反应生成p |