题目内容
18.煤燃烧排放的烟气中(主要含SO2、CO2)的SO2形成酸雨、污染大气,对烟气进行脱硫,回答下列问题: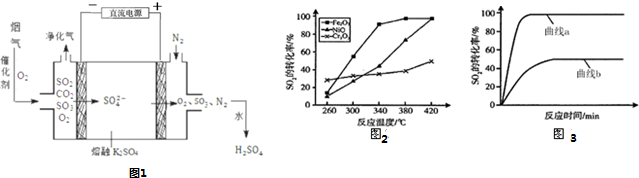
(1)采用Ca(ClO)2烟气脱硫可得到较好的效果.已知下列反应:
SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1
ClO- (aq)+SO32- (aq)═SO42- (aq)+Cl- (aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO- (aq)+2OH- (aq)═CaSO4(s)+H2O(l)+Cl- (aq)的△H=△H1+△H2-△H3.
(2)采用氨水烟气脱硫,最终可得到氮肥.将相同物质的量的SO2与NH3溶于水所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3•H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
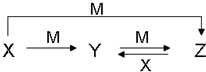
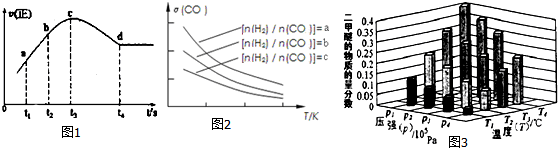
(3)烟气在较高温度经如图1方法脱除SO2,并制得H2SO4.
①在阴极放电的物质是O2.
②在阳极生成SO3的电极反应式是2SO42--4e-=2SO3↑+O2↑.
③已知室温下,Ksp(BaSO4)=1.1×10-10.将脱除SO2后制得的H2SO4配成pH=4 的H2SO4溶液,与pH=9的 Ba(OH)2 溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2 溶液与 H2SO4 溶液的体积比为10:1.欲使溶液中c(SO42-)=2.0×10-4mol•L-1,则应保持溶液中 c(Ba2+)=5.5×10-7mol•L-1.
(4)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:2CO(g)+SO2(g)?催化剂2CO2(g)+S(l)△H=-270KJ•mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择c为该反应的催化剂较为合理(选填序号).
a.Cr2O3 b.NiO c.Fe2O3
选择该催化剂的理由是:Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源.
某科研小组用选择的催化剂,在380℃时,研究了n(CO):n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图3).则图3中表示n(CO):n(SO2)=3:1的变化曲线为a.
分析 (1)①SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
②ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
③CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则根据盖斯定律可知①+②-③即得到反应;
(2)相同物质的量的SO2与NH3溶于水反应生成亚硫酸氢铵;结合溶液中电荷守恒和物料守恒分析判断选项;
(3)①阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-;
②阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2;
③水的离子积常数KW=10-14,pH=9的Ba(OH)2溶液中氢氧根离子浓度为0.00001mol/L,pH=4的H2SO4溶液中氢离子浓度为0.0001mol/L,若所得混合液为中性,酸碱恰好完全反应,氢离子的物质的量等于氢氧根离子的物质的量,据此列式计算出Ba(OH)2 溶液与 H2SO4 溶液的体积比的值;依据Q=c(Ba2+)•c(SO42-)计算溶液中c(SO42-)≤1.0×10-5mol•L-1,则应保持溶液中 c(Ba2+)的值;
(4)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;
n(CO):n(SO2)越大,二氧化硫的转化率越大;
解答 解:(1)已知①SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
②ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
③CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则根据盖斯定律可知①+②-③即得到反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)△H=△H1+△H2-△H3,
故答案为:△H1+△H2-△H3;
(2)相同物质的量的SO2与NH3溶于水发生反应生成碳酸氢铵,反应的离子方程式为SO2+NH3+H2O═NH4++HSO3-,溶液中存在电荷守恒:c(HSO3-)+2c(SO32-)+c(OH-)=c(H+)+c(NH4+),c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),D正确,C错误;溶液中存在物料守恒:c(NH4+)+c(NH3•H2O)=c(HSO3-)+c(SO32-)+c(H2SO3),结合电荷守恒和物料守恒可知c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)=c(SO32-)+c(NH3.H2O)-c(H2SO3),所以A错误,B正确,
故答案为:BD;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑;
③室温下,水的离子积常数KW=10-14,pH=9的Ba(OH)2溶液中氢氧根离子浓度为0.00001mol/L,pH=4的H2SO4溶液中氢离子浓度为0.0001mol/L,若所得混合液为中性,酸碱恰好完全反应,则有:n(H+)=n(OH-),设Ba(OH)2 溶液与 H2SO4 溶液的体积分别为aL、bL,即:0.00001mol/L×aL=0.0001mol/L×bL,a:b=10:1,Ba2+(aq)+SO42-(aq)?BaSO4(s),室温下,Ksp(BaSO4)=1.1×10-10,欲使溶液中c(SO42-)=2.0×10-4mol•L-1,Q=c(Ba2+)•c(SO42-)则应保持溶液中 c(Ba2+)≥$\frac{Ksp(BaS{O}_{4})}{2.0×1{0}^{-4}}$=$\frac{1.1×1{0}^{-10}}{2.0×1{0}^{-4}}$=5.5×10-7mol•L-1,
故答案为:10:1; 5.5×10-7;
(4)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源,故选Fe2O3作催化剂,n(CO):n(SO2)越大,二氧化硫的转化率越大,故曲线a表示n(CO):n(SO2)=3:1的变化曲线,
故答案为:c;Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源;a;
点评 本题考查PH的简单计算、沉淀溶解平衡计算、盐类水解、原电池等,综合考查学生化学知识的应用能力和分析问题的能力,为高考常见题型,注意把握盐类水解和弱电解质的电离特点.注意若离子积Q大于>Ksp(BaSO4),则析出沉淀,反之,则无,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
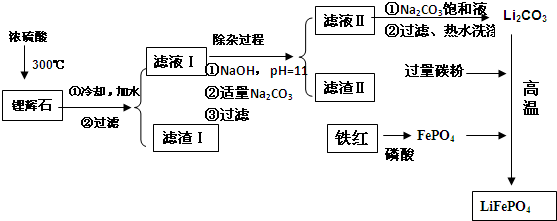
已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
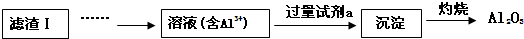
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式)
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
(5)磷酸亚铁锂电池总反应为:FePO4+Li $?_{充电}^{放电}$ LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:FePO4+Li++e-=LiFePO4.若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况、产生时,该电池消耗锂的质量为1.4g.
| A. | 过滤 | B. | 用分液漏斗分液 | ||
| C. | 通入足量CO2后,过滤 | D. | 加入适量NaOH溶液,反应后再分液 |
| A. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| B. | 1L 2 mol•L-1的AlCl3溶液中含Al3+数为2NA | |
| C. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| D. | 室温下,8g甲烷含有共价键数为2NA |
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |

 ,AC2的电子式
,AC2的电子式