题目内容
20.下列不能用勒夏特列原理解释的是( )①盛满二氧化氮的烧瓶浸入热水中颜色变深 ②新制的氯水在光照条件下颜色变浅
③在H2、I2和HI组成的平衡体系中,加压,混合气体颜色变深 ④可用浓氨水和氢氧化钠固体快速制取氨气
⑤高锰酸钾溶液加水稀释后颜色变浅 ⑥加催化剂有利于氨氧化反应
⑦500℃左右比室温更有利于合成氨的反应 ⑧收集氯气用排饱和食盐水的方法.
| A. | ②③⑤⑥ | B. | ③⑤⑥⑧ | C. | ③⑤⑥⑦ | D. | ④⑥⑦⑧ |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:①盛满二氧化氮的烧瓶浸入热水中颜色变深,升高温度平衡向生成二氧化氮的方向移动,导致二氧化氮浓度增大,颜色加深,可以用平衡移动原理解释,故不选;
②新制的氯水在光照条件下颜色变浅,是因为升高温度促进次氯酸分解导致氯气的反应向正反应方向移动,可以用平衡移动原理解释,故不选;
③在H2、I2和HI组成的平衡体系中,加压,混合气体颜色变深,容器体积减小,气体颜色加深,但平衡不移动,不能用平衡移动原理解释,故选;
④浓氨水加入氢氧化钠固体,氢氧化钠固体溶解放热,使一水合氨分解生成氨气的,化学平衡NH3+H2O?NH3•H2O?NH4++OH-,逆向进行,能用化学平衡移动原理解释,故不选;
⑤高锰酸钾溶液加水稀释后颜色变浅,溶液浓度降低,但平衡不移动,不能用平衡移动原理解释,故选;
⑥加催化剂有利于氨氧化反应,是因为改变化学反应速率,但不影响平衡移动,不能用平衡移动原理解释,故选;
⑦500℃左右比室温更有利于合成氨的反应,升高温度增大反应速率缩短反应时间,但升高温度平衡逆向移动,不能用平衡移动原理解释,故选;
⑧氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以勒夏特列原理解释,故不选;
故选C.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.

| A. | 铝比铁化学性质活泼 | |
| B. | 铝表面有一层致密氧化膜起保护作用 | |
| C. | 铝性质太活泼已经全部被氧化成了氧化铝 | |
| D. | 铁有可能只失去二个电子而铝失三个电子,从而比铝更容易被氧化 |
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.
(2)物质的量浓度均为0.1mol/L的六种溶液:
a.CH3COONa、b.Na2CO3、c.NaClO、d.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为b>f>c>d>a>e(用编号填写).
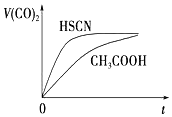
(3)25℃时,将20mL0.1mol•L-1CH3COOH溶液和20mL0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示.反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).$\frac{c(C{N}^{-})}{c(HCN)}$=$\frac{6.2×1{0}^{-10}}{1{0}^{-8}}$ (填代入数据后的计算式,不必算出具体数值).
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
(6)25C时,0.18mol/L醋酸钠溶液的PH约为9.
| A. | 丙烯(CH2=CHCH3)易发生加成反应,一定条件下也可能发生取代反应 | |
| B. | 若有机物甲和乙是同分异构体,则甲和乙的化学性质相似 | |
| C. | 某有机物燃烧只生成物质的量之比为l:2 的CO2和H2O,说明其最简式为CH4 | |
| D. | 分子式分别为C2H6O、C3H8O的有机物一定互为同系物 |
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 一学生用pH试纸测得某氯水的pH为2 | |
| C. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| D. | 配制硫酸亚铁溶液,是将晶体溶于蒸馏水再加入一定量的铁粉 |
| A. | 称取7.68gCuSO4加水配成480mL溶液 | |
| B. | 称取12.5g 胆矾,加水配成500mL溶液 | |
| C. | 称取8.0CuSO4,加水500mL 溶解配成溶液 | |
| D. | 称取12.0g胆矾,加水480mL溶解配成溶液 |

 ,AC2的电子式
,AC2的电子式
